THEdeelsluchu je laboratórny, priemyselný alebo domáci postup, pri ktorom sa používa určitý objem solventný (čistý) sa pridá alebo odstráni (pomocou odparenia) z už existujúceho roztoku.
V každom roztoku je vždy prítomné rozpúšťadlo a najmenej jedna rozpustená látka, ako v zmesi 500 ml vody a 10 g chlorid sodný (NaCl) znázornené nižšie:
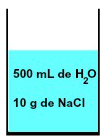
Reprezentácia zmesi tvorenej vodou a chloridom sodným
Ak sa k tomuto roztoku pridá objem 300 ml vody, vykoná sa tento postup zriedeniekeď sa objem roztoku zvýši - v tomto prípade na 800 ml -, avšak bez zmeny množstva rozpustenej látky.

Riedenie pridaním rozpúšťadla do soľného roztoku
THE zriedenie môže sa tiež uskutočniť zahriatím tohto soľného roztoku (zloženého z 500 ml vody a 10 g NaCI), až kým sa napríklad nespracuje 300 ml vody. odparené. V takom prípade by sa znížil objem roztoku, avšak množstvo rozpustenej látky by sa nezmenilo.

Zriedenie odparením rozpúšťadla vo soľnom roztoku
Zásady riedenia:
Konečný objem roztoku, keď je pridané rozpúšťadlo, je vždy väčší ako pôvodný objem;
Konečný objem roztoku, keď sa odstráni rozpúšťadlo, je vždy menší ako pôvodný objem;
Hmotnosť rozpustenej látky sa pri zriedení roztoku nikdy nezmení;
Molárne číslo rozpustenej látky sa pri zriedení roztoku nikdy nezmení;
Ak sa k zriedeniu pridá rozpúšťadlo, koncentrácia konečného roztoku je vždy nižšia ako koncentrácia pôvodného roztoku;
Ak sa rozpúšťadlo odstráni v zriedení, koncentrácia konečného roztoku je vždy vyššia ako koncentrácia pôvodného roztoku.
Vzorce použité pri riedení
⇒ Výpočet konečného objemu roztoku:
Objem konečného roztoku v zriedení, do ktorého sa pridá rozpúšťadlo, sa vypočíta podľa tohto výrazu:
V.f = Vi + VThe
V.f = objem konečného roztoku
V.i = objem počiatočného roztoku
V.The= objem pridaného rozpúšťadla
Ak dôjde k odstráneniu rozpúšťadla v zriedenom roztoku, konečný objem sa vypočíta takto:
V.f = Vi - Va
V.a = objem odpareného rozpúšťadla.
⇒ Výpočet spoločná koncentrácia:
Koncentráciu konečného roztoku po zriedení možno vypočítať takto:
Çi.Vi = C.f.Vf
Çi= bežná koncentrácia východiskového roztoku
V.i = objem počiatočného roztoku
Çf = molarita alebo koncentrácia konečného roztoku v mol / L
V.f= objem konečného roztoku
⇒ Výpočet molarita alebo koncentrácia v mol / l:
Molaritu výsledného roztoku po zriedení možno vypočítať pomocou tohto výrazu:
Mi.Vi = M.f.Vf
Mi= molarita alebo koncentrácia počiatočného roztoku v mol / L
V.i = objem počiatočného roztoku
Mf = molarita alebo koncentrácia konečného roztoku v mol / L
V.f= objem konečného roztoku
⇒ Výpočet hromadného názvu:
Názov finálneho roztoku po zriedení sa dá vypočítať podľa tohto výrazu:
Ti.mi = Tf.mf
Ti= názov pôvodného riešenia
mi = hmotnosť počiatočného roztoku
Tf = názov konečného riešenia
mf= hmotnosť konečného roztoku
Pretože názov sa dá vypočítať aj ako percento a vo vodných roztokoch má hmotnosť obvykle rovnakú hodnotu ako objem, môžeme použiť nasledujúci matematický výraz:
Pi.Vi = Pf.Vf
Teraz neprestávajte... Po reklame je toho viac;)
Pi= percento pôvodného roztoku
V.i = objem počiatočného roztoku
Pf = percento konečného roztoku
V.f= objem konečného roztoku
Príklady výpočtov uskutočňovaných v zriedení:
1. príklad - (UFBA) Pridaním 300 ml vody k 100 ml 8% roztoku hydrogenuhličitanu sodného je koncentrácia získaného roztoku:
a) 24% b) 18% c) 9% d) 4% e) 2%
Údaje poskytnuté cvičením:
Percento pôvodného roztoku (stri) = 8%
Počiatočný objem roztoku (Vi) = 100 ml
Objem konečného roztoku (Vf) = 400 ml (výsledok zmiešania z 300 ml do 100 ml)
Percento konečného roztoku (strf) = ?
Na výpočet percentuálnej koncentrácie roztoku môžeme použiť tieto hodnoty uvedené v nasledujúcom výraze:
Pi.Vi = Pf.Vf
8 100 = pf.400
800 = strf.400
Pf = 800
400
Pf = 2%
2. príklad - (UFPA) 200 ml roztoku hydroxidu horečnatého, Mg (OH)2, boli pripravené rozpustením 2,9 g bázy vo vode. Aký objem tohto roztoku sa musí zriediť na 300 ml, aby sa získal roztok s molaritou rovnou 0,125 M? Údaje: H = 1; Mg = 24; O = 16.
a) 450 ml b) 150 ml c) 400 ml d) 300 ml e) 900 ml
Údaje poskytnuté cvičením:
Hmotnosť rozpustenej látky v počiatočnom roztoku (m1) = 2,9 g
Objem roztoku, ktorý sa má použiť na zriedenie = 200 ml alebo 0,2 l (po vydelení 1000)
Počiatočný objem roztoku (Vi) ktoré sa zriedia =?
Objem konečného roztoku (Vf) = 300 ml
Molarita alebo koncentrácia konečného roztoku v mol / L (Mf) = 0,125 mil
Na výpočet percentuálnej koncentrácie roztoku musíme urobiť nasledovné:
Krok 1: Vypočítajte molárnu hmotnosť rozpustenej látky.
Za týmto účelom musíme vynásobiť počet atómov každého prvku jeho príslušnou atómovou hmotnosťou a potom pridať výsledky:
MMg (OH) 2 = 1.24 + 2.16 + 2.1
MMg (OH) 2 = 24 + 32 + 2
MMg (OH) 2 = 58 g / mol
Krok 2: Vypočítajte koncentráciu počiatočného roztoku v mol / l alebo v molarite:
Mi = m1
MV
Mi = 2,9
58.0,2
Mi = 2,9
11,6
Mi = 0,25 mol / l
Krok 3: Určte objem roztoku, ktorý sa bude riediť, pomocou hodnôt uvedených v nasledujúcom výraze:
Mi.Vi = M.f.Vf
0,25 V.i = 0,125.300
0,25 V.i = 37,5
V.i = 37,5
0,25
V.i = 150 ml
3. príklad - (UEG-GO) Zvážte, že 100 ml vodného roztoku síranu meďnatého s koncentráciou rovnou 40 g. Ľ–1Bolo pridaných 400 ml destilovanej vody. V takom prípade bude mať každý ml nového roztoku hmotnosť v mg, ktorá sa rovná:
a) 2 b) 4 c) 8 d) 10
Údaje poskytnuté cvičením:
Objem vody pridanej k zriedeniu = 400 ml
Počiatočný objem roztoku (Vi) = 100 ml
Objem konečného roztoku (Vf) = 500 ml (výsledok zmiešania zo 400 ml do 100 ml)
Spoločná koncentrácia počiatočného roztoku (Ci) = 40 g. Ľ–1
Spoločná koncentrácia konečného roztoku (Cf) v mg / ml =?
Na výpočet koncentrácie roztoku v mg / ml musíme urobiť nasledovné:
Krok 1: Konvertujte východiskovú koncentráciu roztoku z g / l na mg / ml.
Aby sme to dosiahli, musíme čitateľa aj menovateľa vynásobiť číslom 1000 a danú koncentráciu iba vydeliť číslom 1000:
Çi = 40 g 1 000
1L. 1000
Çi = 40 mg / ml
Preto sú jednotky g / L a mg / ml rovnaké.
Krok 2: Vypočítajte koncentráciu v mg / ml pomocou hodnôt uvedených v nasledujúcom výraze:
Çi.Vi = C.f.Vf
40,100 = Cf.500
4000 = Cf.500
Çf = 4000
500
Çf = 8 mg / ml
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Čo je to riedenie?“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diluicao.htm. Prístup k 28. júnu 2021.