valenčná vrstva je to najvzdialenejšia vrstva (alebo úroveň) (najďalej od jadra) atómu, to znamená tá, ktorá je najďalej od jadra. Preto má takzvané najvzdialenejšie elektróny alebo valenčné elektróny.
Počet úrovní, ktoré môže atóm obsahovať, sa pohybuje od 1 do 7, ktoré majú nasledujúce úrovne (žlté):
úroveň K (1. vrstva): podúrovňa s
úroveň L (2. vrstva): podúrovne s a P
úroveň M (3. vrstva): podúrovne s, P a d
úroveň N (4. vrstva): podúrovne s, P, d a f
úroveň O (5. úroveň): podúrovne s, P, d a f
Úroveň P (6. úroveň): podúrovne s, P a d
úroveň Q (1. vrstva): podúrovne s a P
Každá z podúrovní obsahuje iný počet elektrónov. Pozri:
podúroveň s obsahuje najviac 2 elektróny;
podúroveň p obsahuje najviac 6 elektrónov;
podúroveň d obsahuje najviac 10 elektrónov;
podúroveň f obsahuje najviac 14 elektrónov.
Ak je teda valenčná škrupina určitého atómu M, maximálny počet elektrónov, ktorý môže byť v nej prítomných 18 (2 elektróny z podúrovne s + 6 elektrónov z podúrovne p + 10 elektrónov z podúrovň d).
Na určenie valenčnej škrupiny atómu a počtu elektrónov, ktoré existujú, existujú dva spôsoby, a to:
→ Stanovenie valenčného plášťa a jeho počtu elektrónov z elektronickej distribúcie
Elektronické distribúcie sa vždy uskutočňujú prostredníctvom internetu Schéma Linusa Paulinga, zobrazené nižšie:

Znázornenie Linus Paulingovho diagramu
Obyčajné atómové číslo (čo udáva počet elektrónov v atóme), urobíme elektronickú distribúciu. Napríklad atóm s atómovým číslom 50:

Elektronické rozdelenie atómu s atómovým číslom rovnajúcim sa 50
Pri analýze vyššie uvedenej distribúcie máme za to, že najďalej od jadra je úroveň 5. (úroveň N), v ktorej máme prítomnosť 4 elektrónov (dva v podúrovni s a 2 v podúrovni p).
→ Určenie valenčného plášťa a jeho počtu elektrónov z Periodickej tabuľky
Tabuľka je usporiadaná v bodkách (vodorovné stĺpce), ktoré označujú počet úrovní atómu, a skupín alebo skupín (zvislé stĺpce). Obdobie sa používa na určenie valenčná vrstvaa rodiny sa používajú na určenie počtu elektrónov.
a) Poznanie periódy chemického prvku
Periodická tabuľka predstavuje celkom sedem období, ktorých počet súvisí s počtom úrovní prítomných v diagrame Linusa Paulinga. Takže, ak poznáme obdobie, v ktorom chemický prvok je to v tabuľke, automaticky, vieme, koľko úrovní majú vaše atómy, valenčná vrstva je úrovňou najďalej od jadra.
1. príklad: Chemický prvok Draslík
Draslík je umiestnený vo štvrtej perióde periodickej tabuľky, takže jeho atóm má štyri úrovniach, štvrtou úrovňou je valenčná vrstva, čo sa potvrdzuje jej distribúciou elektronika.
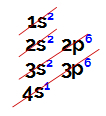
Elektronická distribúcia prvku draslíka
2. príklad: Chemický prvok Fluór
Fluór je umiestnený v druhej perióde periodickej tabuľky, takže jeho atóm má dve úrovne, druhou úrovňou je valenčná vrstva, čo sa potvrdzuje jej distribúciou elektronika.

Elektronická distribúcia fluórového prvku
3. príklad: Indický chemický prvok
Ind je umiestnený v piatej perióde periodickej tabuľky, takže jeho atóm má päť piatej úrovni je valenčná vrstva, čo sa potvrdzuje jej distribúciou elektronika.

Elektronická distribúcia indiového prvku
b) Poznanie rodiny alebo skupiny chemického prvku
Ak poznáme rodinu alebo skupinu, v ktorej je prvok umiestnený, poznáme tiež počet elektrónov prítomných vo valenčnom obale tohto prvku.
Prvky rodiny A
Prvky skupín A sú umiestnené v stĺpcoch 1, 2, 13 až 18 periodickej tabuľky. Každý z týchto stĺpcov dostáva číslo (1 až 8, rímske číslo), ktoré označuje presný počet elektrónov vo valenčnom plášti týchto prvkov:
Stĺpec 1 - rodina IA = všetky majú 1 elektrón vo valenčnom plášti;
Stĺpec 2 - rodina IIA = všetky majú vo valenčnej škrupine 2 elektróny;
Stĺpec 3 - rodina IIIA = všetky majú 3 elektróny vo valenčnom plášti;
Stĺpec 4 - rodina IVA = všetky majú vo valenčnej škrupine 4 elektróny;
Stĺpec 5 - VA rodina = všetky majú 5 elektrónov vo valenčnom plášti;
Stĺpec 6 - VIA rodina = všetky majú 6 elektrónov vo valenčnom plášti;
Stĺpec 7 - rodina VIIA = všetky majú 7 elektrónov vo valenčnom plášti;
Stĺpec 8 - rodina VIIIA = všetky majú vo valenčnej škrupine 8 elektrónov.
Pozri niekoľko príkladov stanovenia počtu valenčných elektrónov niektorých prvkov rodiny A:
Príklad 1: chemický prvok bárium
Bárium sa nachádza v rodine IIA, takže má vo valenčnej škrupine dva elektróny, čo potvrdzuje jeho elektronická distribúcia:

Elektronická distribúcia bárnatého prvku
Príklad 2: Antimonový chemický prvok
Antimón sa nachádza v rodine VA, takže má vo valenčnej škrupine päť elektrónov, čo potvrdzuje aj jeho elektronická distribúcia:

Elektronická distribúcia antimónového prvku
Príklad 3: Xenónový chemický prvok
Xenón sa nachádza v rodine VIIIA, takže má vo valenčnej škrupine osem elektrónov, čo potvrdzuje aj jeho elektronická distribúcia.

Elektronická distribúcia xenónového prvku
POZNÁMKA: jediný chemický prvok patriaci do rodiny A, ktorý nie je v súlade s navrhovaným pravidlom, je hélium. Patrí do rodiny VIIIA, ale má len dva elektróny vo valenčnej škrupine. Je to preto, lebo jeho atómové číslo je 2, takže je nemožné, aby mal vo valenčnej škrupine 8 elektrónov ako ostatné prvky v rodine.
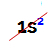
Elektronická distribúcia atómu hélia
Prvky rodiny B.
Prvky skupín B sú umiestnené v stĺpcoch 3 až 12 periodickej tabuľky. Okrem rodín A existuje aj osem rodín B, ktoré sú reprezentované rímskymi číslicami. Na rozdiel od A rodín počet B rodiny neurčuje počet elektrónov vo valenčnom plášti.
Počet elektrónov vo valenčnom obale prvku rodiny B je vždy rovný 2, bez ohľadu na atómové číslo a polohu v tabuľke. Elektronické distribúcie kalifornia (98Porov.) A Hassius (108hs) dokázať toto:
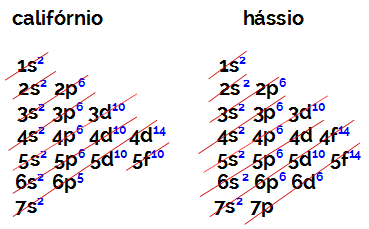
Elektronická distribúcia kalifornia má ako najenergetickejšiu podúrovňu 5f10, a o Hasius je 6d6. V obidvoch prípadoch je subúroveň najvzdialenejšia od jadra siedma úroveň a obe majú dva distribuované elektróny.
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-camada-valencia.htm
