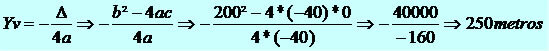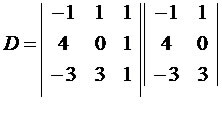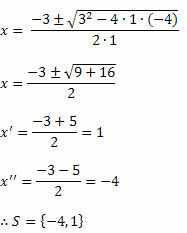Ipoteza Avogadro, propusă în 1811 de Amedeo Avogadro, spune că:
Volumele egale ale oricăror gaze, în aceleași condiții de presiune și temperatură, au aceeași cantitate de substanțe în aluni (molecule).
Această lege este legată de volumul molar al gazelor.
Conceptul de volum molar al gazelor: volum ocupat de un mol din orice gaz, la o presiune și temperatură date.
Având în vedere că volumul molar pentru orice gaz este de 22,4 L / mol, avem că relația dintre volum și numărul de mol este constantă:
V = K
N
Ecuația exprimă faptul că 22,4 litri de orice gaz au 6,02 x 1023 molecule (condiții de 1 atm și 0 ° C).
De exemplu:
Dacă umplem un balon cu gaz Helium (He) vom avea un volum de 22,4 litri și 6,02 x 1023 molecule de gaz. Dar dacă umflăm același balon până când acesta ocupă același volum, numai cu un alt gaz, hidrogen (H2), de exemplu, câte molecule de H2 am avea? Aceeași cantitate = 6,02 x 1023 molecule.
Volumul este practic același pentru orice gaz, având în vedere că dimensiunea unei molecule de gaz este neglijabilă în comparație cu spațiul gol dintre ele.
De Líria Alves
Absolvent în chimie
Echipa școlii din Brazilia
Vezi mai mult! Volumul molar al gazelor
Chimie generală - Chimie - Școala din Brazilia
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/relacao-entre-lei-avogadro-gases.htm