Od najdawniejszych czasów człowiek interesował się odpowiedzią na pytanie o budowę materii.
Kilka osobistości ze środowiska naukowego zajęło stanowisko w tej sprawie, ale dopiero pod koniec XIX wieku zaczęto odkrywać tajemnice dotyczące składu atomowego.
Na przykład starożytny filozof Leucippus wierzył, że atom składa się z maleńkich cząstek.
Po tej definicji Demokryt i Dalton zaproponowali, że cząstki atomowe są masywne i niepodzielne.
Fakt ten został później zakwestionowany przez Thomsona, angielskiego fizyka, który odkrył istnienie elektronu i był w stanie potwierdzić ideę zaproponowaną wcześniej przez Leucipo.
Po tym odkryciu Thomson zaprezentował model, w którym atom tworzy kula z ładunkami dodatnimi, a wewnątrz jądra znajdują się elektrony.
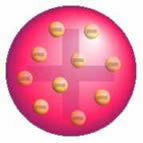
Model atomu Thomsona - W dodatnio naładowanej, równomiernie rozłożonej sferze masy,
byłyby inkrustowane ujemnie naładowanymi elektronami, jak w budyniu.
Nawet po teorii Thomsona model atomowy wciąż miał teoretyczno-eksperymentalny brak, zdolny do udowodnienia jego prawdziwości.
Temat był ponownie gorąco dyskutowany, gdy zespół fizyka Rutherforda zaobserwował bardzo duże odchylenie (i niewytłumaczalne, zgodnie z teorią budyniu z rodzynków), gdy niektóre radioaktywne cząstki alfa przeszły przez cienką warstwę blaszki metaliczny.
Po przeanalizowaniu i zbadaniu tego faktu Rutherford doszedł do wniosku, że promień atomu jest 10 000 razy większy niż promień jądra.
Poprzez wszystkie badania atomu Rutherford i jego zespół doszli w 1911 roku do modelu atomowego, który nazwali planetarnym modelem atomu.

W 1913 Niels Bohr rozszyfrował model atomowy, stosując w swoich badaniach kwant działania odkryty przez Plancka. Kwant działania był w rzeczywistości wielką dziką kartą, która miała uzupełnić i wyjaśnić model atomowy.
Bohr sprawnie i prosto dostosował model przedstawiony przez Rutherforda, dochodząc do następującego wniosku:
Elektron uzyskuje energię, która jest reprezentowana przez określoną orbitę. Dozwolone orbity tworzą poziomy energii.

Autor: Talita A. anioły
Ukończył fizykę
Brazylijska drużyna szkolna
Fizyka Nowoczesny - Fizyka - Brazylia Szkoła
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm
