Ogromna większość materiałów występujących w przyrodzie, w naszym społeczeństwie i w naszych ciałach nie jest czystymi substancjami, ale w rzeczywistości mieszanki dwóch lub więcej Substancje.
Chociaż przez większość czasu nazywamy wodę mineralną tylko „wodą”, w rzeczywistości zawiera ona nie tylko czystą substancję H2O, ponieważ jest wynikiem procesu, w którym woda deszczowa wnika w glebę i przechodzi przez różne skały.
Tak więc, jak sama nazwa wskazuje, oprócz wody zawiera również kilka rozpuszczonych minerałów. Jeśli jesteś ciekaw, aby sprawdzić etykietę jakiejkolwiek wody mineralnej, zobaczysz, że ma ona w swoim składzie chemia siarczany strontu, wapń, sód, potas, wodorowęglan sodu, fluorek sodu, wśród inne.
Mapa myśli: Mieszanki
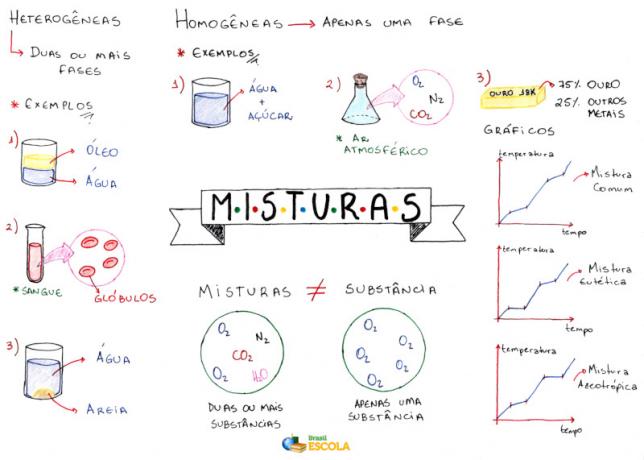
* Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
Jak odróżnić substancję od mieszaniny?
Pokazana poniżej woda destylowana jest czystą substancją zawierającą tylko H2O:

Woda destylowana używana w laboratorium
Wizualnie wygląda dokładnie jak mieszanina wody i soli; jednak można je odróżnić od definicji mieszanki. Popatrz:
→ Mieszanki to materiały, których właściwości fizyczne nie są stałe, ale zmieniają się w określonej temperaturze i ciśnieniu.
Więc po prostu zmierz właściwości fizyczne, takie jak temperatura topnienia i wrzenia oraz gęstość. Jeśli są stałe i dobrze zdefiniowane, jest to a czysta substancja (w przypadku wody destylowanej w temp. 4°C jej gęstość wynosi 1,0 g/cm3 a na poziomie morza temperatury topnienia i wrzenia wynoszą odpowiednio 0°C i 100°C).
Jeśli jednak przedstawiane są wariacje, jest to mieszanka. Jeśli podgrzejesz mieszaninę wody z solą, aby sprawdzić temperaturę wrzenia, zobaczysz, że podczas zmiany stanu ciekłego na gazu, temperatura nie pozostaje stała, jak w przypadku wody destylowanej, która pozostaje w temperaturze 100 ° C, aż cała ciecz się obraca parowy.
Teraz są tam mieszanki że nie trzeba nawet określać ich właściwości fizycznych, aby wiedzieć, że są mieszaninami, wystarczy spojrzeć, jak ma to miejsce w przypadku następującej mieszaniny wody i oleju:

Mieszanina utworzona przez wodę i olej
Wskazuje to, że istnieją różne rodzaje mieszanin, które można podzielić na jednorodne i niejednorodne. Zobacz każdy:
Mieszanki jednorodne:
Są to takie, które mają jednolity wygląd, z jedną fazą (jednofazowy). Przykłady:
sól fizjologiczna (0,9 g chlorku sodu w 100 ml wody);
solanka (36 g soli, takich jak chlorek sodu, chlorek magnezu, jodan potasu, antyhumektanty i 100 ml wody);
uwodniony alkohol (etanol i woda);
powietrze (78% gazowy azot, 20% gazowy tlen, 2% inne gazy i para wodna);
stal (stop metali składający się z 98,5% żelaza i 1,5% węgla).

Sól fizjologiczna, stal i formaldehyd, przykłady mieszanin jednorodnych
Powyższe przykłady pokazują, że mieszanki jednorodne mogą być w stanie stałym, ciekłym lub gazowym. Te jednorodne mieszaniny nazywane są rozwiązania i nie można ich rozdzielić metodami fizycznymi, a jedynie technikami chemicznymi. Aby np. oddzielić alkohol od wody, konieczne jest przeprowadzenie procesu: destylacja, ponieważ odwirować lub filtrowanie to nie wystarczy.
Ponadto ważne jest, aby podkreślić, że muszą być jednorodny nawet patrząc pod ultramikroskopem. Na przykład gołym okiem mleko i krew mogą wyglądać jednorodnie, ale pod ultramikroskopem widzimy, że w rzeczywistości są heterogeniczny. Zobacz obraz krwi pod ultramikroskopem i jej poszczególne fazy po umieszczeniu jej w ultrawirówce:
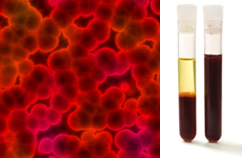
Obraz mikroskopowy i fazy krwi
Mieszaniny heterogeniczne:
Czy te, które mają więcej niż jedną fazę. Przykłady: woda i olej, woda i piasek, lód i woda, granit, woda i żelazo, nierozpuszczona sól w wodzie itp.
Składniki mieszaniny niejednorodne w większości przypadków występują one w różnych stanach fizycznych i można je rozdzielić metodami fizycznymi. Przykład ma miejsce, gdy robimy kawę i filtrujemy ciało stałe, oddzielając je od cieczy.
Ale nie zawsze tak się dzieje, jak pokazano w przypadku oleju i wody, które choć są cieczami, nie rozpuszczają się z powodu różnych polaryzacje jego cząsteczek.
Mapa mentalna Matka Victor Ricardo Ferreira
Nauczyciel chemii
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm

