dzieje się transformacjaizochoryczny kiedy dana masa gazu ulega zmianom w temperatura które powodują zmiany ciśnienia lub odwrotnie, biorąc pod uwagę, że temperatura i nacisk, w tym przypadku są wielkościami wprost proporcjonalnymi, podczas gdy głośność systemu pozostaje niezmieniona.
Zobacz też: Co to jest ciśnienie parcjalne gazów?
Czym jest transformacja izochoryczna?
Transformacja izochoryczna ma miejsce, gdy w danej masie gazu zachodzi zmiana temperatury i ciśnienia, ale jego objętość pozostaje taka sama. Zmiana ciśnienia będzie wprost proporcjonalna do temperatury, to znaczy, że jeśli gaz w pewnym układzie zamkniętym podwoi swoją temperaturę bezwzględną, spowoduje to dwukrotny wzrost ciśnienia.
Ten rodzaj transformacji jest również nazywany izowolumetryczny lub izometryczny. Termin izochoryczny pochodzi z greki Izochora, na czym? iso oznacza "równy" i khora oznacza „miejsce lub objętość” (w tym kontekście).
Przykłady:
Opony samochodu ulegają izochorycznej przemianie, możemy to zaobserwować, gdy wykonamy jego
kalibrowanie. W upalne dni ciśnienie podawane na monitorze kalibracyjnym jest wyższe niż w zimne dni. Dzieje się tak, ponieważ wraz ze wzrostem temperatury ciśnienie wzrasta, ponieważ objętość pozostaje.
Inne przykłady to dezodoranty w sprayu, na wyrobie tego typu znajduje się ostrzeżenie na etykiecie, aby nie przechowywać ani nie narażać na działanie wysokich temperatur, ponieważ oprócz tego, że niektóre z jego substancji są palne, istnieje warunek przemiany izochorycznej lub izowolumetryczny. Ponieważ dezodoranty w aerozolu znajdują się w zamkniętej butelce i są w stanie gazowym, wzrost temperatury spowoduje wzrost ciśnienia i ryzyko wybuchu.
Charakterystyka transformacji izochorycznej
- Stała objętość.
- Ciśnienie i temperatura są wprost proporcjonalne.
Cechy te można opisać następującymi wzorami:

Wykres funkcji izochorycznej
Zwróć uwagę na poniższą tabelę, która opisuje zachowanie gazu w zależności od ciśnienia, temperatury i wynikającej z tego stałej.
Temperatura (°C) |
Ciśnienie (atm) |
P/T = stała |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Należy zauważyć, że ciśnienie podąża za wzrostem temperatury, więc stosunek P/T pozostaje stały, co oznacza, że ciśnienie i temperatura są wielkościami wprost proporcjonalnymi. Dlatego wykres opisujący przekształcenia izochoryczne ma charakter liniowy. Popatrz:

Kto odkrył transformację izochoryczną?
Jacques Alexandre César Charles (1746-1823) był francuskim naukowcem, który badając zachowanie gazów w układzie zamkniętym w celu stworzenia precyzyjnego termometru, zakończył badania nad przemianami izochorycznymi.
Naukowiec Joseph Louis Gay-Lussac (1778-1850) opracowali również badanie rozszerzania i kurczenia się układu gazowego. Były to niezależne analizy, ale ponieważ doszły do tego samego wniosku, podzielono punkty. Dzisiaj niektórzy autorzy odwołują się do dwóch ostatnich praw fizycznych gazów, które wyjaśniają przekształcenia izobaryczne i izochoryczne jak 1. i 2. prawo Charlesa-Gay-Lussaca.
Zobacz też: Prawo wolumetryczne Gay-Lussaca
Ćwiczeniazdecydowany
Pytanie 1 - (PUC-RJ) Opona rowerowa jest kalibrowana przy ciśnieniu 4 atm, w zimny dzień, w temperaturze 7 °C. Objętość i ilość wtłaczanego gazu są takie same. Jakie będzie ciśnienie kalibracyjne w oponie, gdy temperatura osiągnie 37°C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Rozkład
Alternatywa A
Krok 1: zidentyfikuj system i wyodrębnij dane.
System izowolumetryczny
P1 = 4 atm
T1 = 7°C
T2 = 37°C
P2 = ?
Korzystając ze wzoru:
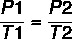
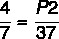
7 x P2 = 37 x 4
P2 = 148 / 7
P2 = 21,14 atm
Pytanie 2 - (Unifor-CE) Sprawdź poniższy rysunek.
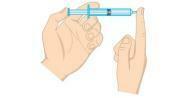
Ciśnienie gazu wewnątrz strzykawki można zmniejszyć:
a) umieszczenie strzykawki w lodowatej wodzie, trzymając zatyczkę na końcu.
b) ściśnięcie tłoka, trzymając zatyczkę na końcu.
c) umieszczenie strzykawki w gorącej wodzie, trzymając zatyczkę.
d) otwarcie końcówki i wypuszczenie połowy powietrza ze strzykawki.
e) pociągnięcie tłoka z otwartym końcem.
Rozkład
Alternatywa A. Ciśnienie gazu jest wprost proporcjonalne do temperatury w układzie izochorycznym, to znaczy bez zmiany objętości lub masy gazu. W przypadku spadku temperatury nastąpi również spadek ciśnienia.
Laysa Bernardes Marques de Araujo
Nauczyciel chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm

