Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) był włoskim chemikiem, który jako pierwszy ustanowił ideę próbka pierwiastka o masie w gramach liczbowo równej jego masie atomowej ma zawsze taką samą liczbę atomów (N).
Sam Avogadro nie był w stanie określić wartości N. Jednak przez cały XX wiek postęp technologii i wiedzy naukowej umożliwił innym naukowcom opracowanie technik pozwalających to określić. Kiedy w końcu odkryto tę wartość, nazwano ją Stała Avogadro, na cześć tego naukowca, ponieważ to on położył podwaliny pod jego stworzenie.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
W 1 molu dowolnej jednostki (atomów, cząsteczek, elektronów, wzorów lub jonów) zawarta jest dokładnie wartość stałej Avogadro.
Poniższa tabela przedstawia niektóre wartości stałej Avogadro uzyskiwane na przestrzeni XX wieku:
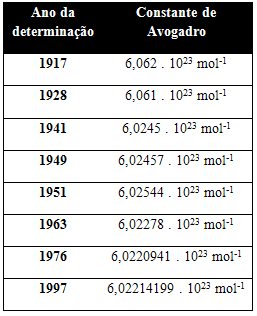
Oto kilka technik użytych do określenia wartości stałej Avogadro:
Pierwszym naukowcem, który dokonał przybliżonych obliczeń stałej Avogadro, był Johann Joseph Loschmidt. W roku 1867 oparł się na kinetycznej teorii gazów i określił, ile cząsteczek istnieje w 1 cm3 gazu.
Innym z tych naukowców był Francuz Jean Baptiste Perrin (1870-1942), który policzył liczbę cząstek koloidalnych na jednostkę objętości zawiesiny i zmierzył ich masy. Wartość, którą znalazł, mieściła się w przedziale od 6,5 do 7,2. 1023 jednostek na mol. Ten naukowiec opublikował w 1913 roku książkę Les Atomes (wyd. 1 Paris: Alcan) i jego 9. edycja, opublikowana w 1924, zawierała 16 sposobów doświadczalnego uzyskania stałej Avogadro.

Jean Baptiste Perrin (1870-1942)
Wiele lat później naukowiec James Dewar (1842-1923) zastosował metodę opracowaną wiele lat wcześniej przez radiochemika Bertrama Boltwooda (1870-1927) i fizyka Ernesta Rutherforda (1871-1937), który w zasadzie polegał na zliczeniu cząstek alfa emitowanych przez źródło radioaktywne i określeniu objętości uzyskanego helu. Wartość znaleziona przez Dewara wyniosła 6,04. 1023 molo-1.
W XX wieku Robert Millikan (1868-1953) przeprowadził eksperyment, aby określić ładunek elektronu (1,6. 10-19 DO). Ponieważ ładunek 1 mola elektronów był już znany (96500 C), możliwe było powiązanie tych dwóch wartości i znalezienie następującej wartości stałej Avogadro: 6,03. 1023 molo-1.
Obecnie zalecaną wartością stałej Avogadro jest 6,02214 x 1023 molo-1 i wyznacza się ją za pomocą dyfrakcji rentgenowskiej, w której uzyskuje się objętość kilku atomów sieci krystalicznej, o ile znana jest gęstość i masa 1 mola atomów w próbce.
Dla celów dydaktycznych w liceum, gdzie obliczenia nie muszą być tak dokładne, jak te wykonywane w laboratoriach chemicznych, stała Avogadro jest traktowana jako 6,02. 1023 molo-1.
Istnieją również prostsze metody, które można wykorzystać, aby pomóc uczniom określić w praktyce stałą Avogadro. Jednym z nich jest elektroliza w środowisku wodnym.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm
