O Model atomowy Schrödingera jest powszechną formą używaną do wyznaczania opis atomu rozwiązując równanie Schrödingera, zaproponowane przez austriackiego fizyka Erwina Schrödingera w 1927 r. Równanie zostało opracowane na podstawie ważnych obserwacji uzyskanych w ramach mechaniki kwantowej, dostarczając solidnego uzasadnienia dla energii atomu i elektronu.
Atom wymyślony przez Schrödingera opiera się między innymi na dualności falowo-cząsteczkowej, zasadzie nieoznaczoności i innych pojęciach ukutych na początku XX wieku. Przyniósł wielki postęp w zrozumieniu materii, ponieważ utorował drogę do bardziej solidnego zrozumienia atomów polielektronowych, co nie jest możliwe w przypadku modelu atomowego zaproponowanego przez Bohra.
Przeczytaj też: Modele atomowe — modele proponowane w celu wyjaśnienia budowy atomu
Tematyka tego artykułu
- 1 - Podsumowanie modelu atomu Schrödingera
- 2 - Co to jest model atomowy Schrödingera?
-
3 - Eksperymentalne podstawy modelu atomu Schrödingera
- Efekt fotoelektryczny
- dualizm korpuskularno-falowy
- zasada nieoznaczoności
- 4 - Charakterystyka modelu atomu Schrödingera
- 5 - Postępy modelu atomowego Schrödingera w stosunku do innych modeli atomowych
Podsumowanie modelu atomowego Schrödingera
Model atomowy Schrödingera jest w rzeczywistości opisem atomu i elektronów za pomocą równania Schrödingera.
Równanie Schrödingera zostało opracowane w wyniku ważnych badań w dziedzinie mechaniki kwantowej.
Dualizm korpuskularno-falowy, między innymi zasada nieoznaczoności, były niezbędne do stworzenia równania Schrödingera.
Rozwiązując równanie Schrödingera, można opisać zarówno energię atomu, jak i elektronu.
Na podstawie interpretacji równania Schrödingera można zauważyć, że elektronów nie ma określona orbita wokół atomu, ale raczej obszar prawdopodobieństwa istnienia wokół atomu od niego.
Badania Schrödingera rozszerzają rozumienie atomu zaproponowane przez Bohra, ponieważ pozwalają zrozumieć zachowanie atomów polielektronowych.
Co to jest model atomowy Schrödingera?
Model atomowy Schrödingera to popularna nazwa opis modelu atomu opartego na mechanice kwantowej. Główną cechą tego modelu jest matematyczna interpretacja dualizmu falowo-cząsteczkowego przyjęta przez elektrony, więcej w szczególności zastąpienie dobrze określonej trajektorii elektronu prawdopodobieństwem istnienia elektronu wokół rdzeń.
Taka interpretacja rozpoczęła się dzięki pracom austriackiego naukowca Erwina Schrödingera w 1927 r., po znaczących postępach w zrozumieniu materii z zakresu mechaniki kwantowej, takich jak efekt fotoelektryczny, zasada nieoznaczoności i dualność cząsteczka falowa.
Zrozumienie modelu atomowego Schrödingera nie jest trywialne, ponieważ zbliża się do niego na bardziej zaawansowanych poziomach chemii.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Eksperymentalna podstawa modelu atomowego Schrödingera
Przed badaniami Erwina Schrödingera nastąpił istotny postęp w dziedzinie zrozumienie materii na początku XX wieku. Takie eksperymenty zapoczątkowały dziedzinę wiedzy teoretycznej znaną jako mechanika kwantowa, która przynosi interpretacje dotyczące zachowania cząstek bliskich lub mniejszych od skali atomowej. W tym konkretnym wszechświecie prawa fizyki klasycznej, zwanej też fizyką newtonowską, często nie mają zastosowania lub nie wystarczają do wyjaśnienia pewnych zachowań.
Aby mieć pojęcie, możemy powiedzieć, że mechanika kwantowa zaczyna się od tematu znanego jako katastrofa ultrafioletowa. Zgodnie z fizyką klasyczną ciało doskonale czarne (gorący obiekt) o temperaturze różnej od zera, oprócz promieniowania gamma i rentgenowskiego, emituje intensywne promieniowanie ultrafioletowe.
Oznacza to, że my, ludzie, z naszą temperaturą 36-37°C, świecilibyśmy w ciemności (konsekwencja żarzenia). Nie trzeba dodawać, że jest to kompletna bzdura, bo gdyby tak było, nie byłoby ciemności.
W tym kontekście, W 1900 roku Max Planck stworzył koncepcję tzw ile, tłumaczone jako „pakiety energii”, w celu wyjaśnienia wymiany energii między materią a promieniowaniem. Według jego interpretacji ciało w niskich temperaturach (jak my) nie ma wystarczającej ilości energii, aby emitować promieniowanie ultrafioletowe o wysokiej częstotliwości.
Zatem ciało może emitować promieniowanie ultrafioletowe o wysokiej częstotliwości tylko wtedy, gdy uzyska minimalną niezbędną energię. W tych warunkach wymiana energii między materią a otoczeniem odbywa się poprzez pakiety energii promieniowania.
Pakiety energii również wnoszą różnicę w stosunku do fizyki klasycznej. Mówiąc o pakietach energii, odnosi się to do energii, która jest skwantowana, czyli jest specyficzna, następuje nałożenie ograniczeń. W fizyce Newtona ilość energii wymienianej między dwoma obiektami nie ma ograniczeń.
Efekt fotoelektryczny
Aby nadać solidność teoriom zaproponowanym przez Plancka, potrzeba było więcej dowodów. W tym kontekście pojawił się efekt fotoelektryczny., który zajmuje się wyrzucaniem elektronów z metalu poprzez padanie na jego powierzchnię promieniowania ultrafioletowego.
Zgodnie z obserwacjami tej teorii, żadne elektrony nie są wyrzucane, dopóki promieniowanie nie osiągnie częstotliwości o określonej wartości, właściwej dla każdego metalu. Po osiągnięciu tej częstotliwości elektrony są natychmiast wyrzucane, a im większa częstotliwość padającego promieniowania, tym szybszy będzie wyrzucany elektron.
A wyjaśnienie efektu fotoelektrycznego podał Albert Einstein. Według Einsteina promieniowanie elektromagnetyczne (na przykład światło jest promieniowaniem elektromagnetycznym), wykorzystywane do wyrzucania elektronów, składało się z cząstki zwane fotonami, a ponadto każdy foton można zinterpretować jako pakiet energii. Na podstawie badań Plancka można było stwierdzić, że fotony promieniowania ultrafioletowego są bardziej energetyczne niż fotony światła widzialnego.

Zderzając się z powierzchnią metalu, fotony (składowe promieniowania elektromagnetycznego) wymieniają energię z obecnymi na niej elektronami. Jeśli energia pochłonięta przez elektron w zderzeniu z fotonami jest wystarczająco duża, zostanie on wyrzucony. Aby dowiedzieć się więcej o efekcie fotoelektrycznym, kliknij Tutaj.
dualizm korpuskularno-falowy
Efekt fotoelektryczny przyniósł mocne podstawy, że promieniowanie elektromagnetyczne składa się z cząstek (fotonów). Jednak wiele innych eksperymentów wykazało, że promieniowanie elektromagnetyczne zachowuje się jak fala. Spośród tych eksperymentów najbardziej uderzająca była dyfrakcja — zjawisko fizyczne obserwowane, gdy fala napotyka przeszkodę lub, według innej interpretacji, zdolność fal do pokonywania przeszkód.
O Falowy charakter światła znany jest od 1801 roku, kiedy angielski fizyk Thomas Young oświetlił barierę ze szczeliną. Przechodząc przez tę szczelinę, światło ulega dyfrakcji. W każdej szczelinie, włączając tę, przez którą przechodzi światło, nawet ugięte, przechodzi ono nową dyfrakcję.

Lubię to, konieczne było zaakceptowanie nowego zachowania promieniowania elektromagnetycznego: dualizm korpuskularno-falowy. Stamtąd francuski naukowiec Louis de Broglie rozszerzył tę koncepcję, sugerując, że wszystkie cząstki należy również rozumieć jako mające zachowanie falowe.
Hipoteza de Broglie'a zyskała na sile w 1925 roku, kiedy amerykańscy naukowcy Clinton Davisson i Lester Germer udowodnił, że wiązka elektronów może ulegać dyfrakcji podczas przechodzenia przez pojedynczy kryształ nikiel.
Ta percepcja była niezbędna do dojścia do wniosku, że cięższe cząstki, takie jak cząsteczki, również mogą ulegać dyfrakcji, a zatem wykazywać zachowanie podobne do fal. Aby dowiedzieć się więcej o dualności falowo-cząsteczkowej, kliknij Tutaj.
zasada nieoznaczoności
W fizyce klasycznej łatwo jest określić trajektorię cząstki. Jednak w świecie kwantowym, w którym cząstki również zachowują się jak fale, ich trajektoria nie jest już tak precyzyjna. To dlatego nie ma sensu mówić o lokalizacji fali.
Na przykład na gitarze, gdy szarpniesz strunę, fala rozchodzi się na całej jej długości. Jeśli cząsteczka zachowuje się tak samo, nie ma nawet możliwości dokładnego określenia jej położenia znając jego pęd liniowy (ilość, która łączy w sobie masę i prędkość).
Dlatego elektron, który również ma dwoisty charakter, nie ma określonej orbity/ścieżki wokół jądra atomowego, jak wielu uważa. Adualność powoduje następnie niepewność co do dokładnego położenia cząstki.
Ta niepewność w definicji położenia jest pomijalna dla bardzo ciężkich ciał, ale w pełni znacząca dla ciał o wielkości atomowej lub subatomowy, czyli jeśli wiesz, że cząstka jest w określonym miejscu, w określonym momencie, nie będziesz już wiedział, gdzie będzie w następnym natychmiastowy.
Z tego dylematu zrodziła się zasada nieoznaczoności., założona przez niemieckiego fizyka Wernera Heisenberga w 1927 roku. Zgodnie z tą zasadą nie jest możliwe poznanie położenia i pędu liniowego cząstki bez marginesu błędu, to znaczy, jeśli jedna właściwość jest znana, druga nie. Aby dowiedzieć się więcej o zasadzie nieoznaczoności, kliknij Tutaj.
Cechy modelu atomu Schrödingera
Ponieważ z powodu dwoistego charakteru cząstki nie można już było określić dla niej określonej trajektorii, w 1927 roku austriacki naukowiec Erwin Schrödinger zastąpił tę precyzyjną trajektorię funkcją falową, reprezentowana przez grecką literę psi (ψ), przy czym wartości tej funkcji różnią się w zależności od pozycji. Przykładem funkcji falowej jest funkcja sinus X.
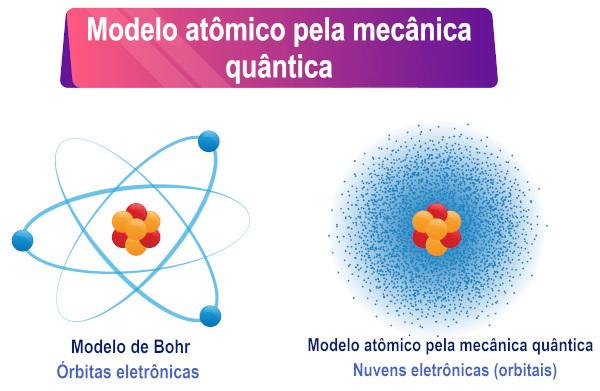
Naukowiec Max Born następnie stworzył fizyczną interpretację funkcji falowej, stwierdzając, że kwadrat funkcji ψ, czyli ψ², byłby proporcjonalny do prawdopodobieństwa znalezienia cząstki w region. Zatem ψ² jest rozumiane jako gęstość prawdopodobieństwa znalezienia cząstki w jakimś obszarze. Ponieważ jest to gęstość prawdopodobieństwa, wartość ψ² należy pomnożyć przez objętość, aby uzyskać prawdziwe prawdopodobieństwo.
Aby obliczyć funkcję falową, Schrödinger opracował równanie, uproszczone w następujący sposób:
Hψ = Eψ
Hψ należy odczytywać jako „psi hamiltona” i opisuje ono krzywiznę funkcji falowej. Hamiltonian jest operatorem matematycznym, podobnie jak plus, minus, logarytm itp. Prawa strona przynosi nam odpowiednią energię.
Rozwiązanie tego równania prowadzi do ważnego wniosku: cząstki mogą mieć tylko dyskretne energies, czyli energie dobrze określone, czyli skwantowane, a nie dowolna wartość. Te specyficzne wartości energii są znane jako poziomy energii. Jest to narzucenie funkcji falowej, ponieważ musi ona pasować do określonego obszaru przestrzeni. W mechanice klasycznej obiekt może mieć dowolną wartość energii całkowitej.
Lubię to, elektron nie może mieć żadnej energii, ale dobrze zdefiniowane poziomy energii. Ponieważ funkcja falowa musi pasować do obszaru przestrzeni, pamiętaj, że a elektron jest zamknięty w atomie poprzez siły przyciągania, które ma dla jądra.
Poziomy energetyczne atomu można obliczyć, rozwiązując odpowiednio równanie Schrödingera. W tym przypadku zauważono, że rozdzielczość osiąga nowe równanie, które pokazuje, że energia każdego poziomu w atomie zależy od liczby całkowitej, zwanej N, co potwierdza tezę, że poziomy energii mają określone wartości.
W ten sposób przypisując wartości dodatnie do N (1, 2, 3...), można obliczyć energię poziomów atomowych. Parametr N jest teraz nazywana główną liczbą kwantową, ponieważ ostatecznie jest powiązana z każdym poziomem atomowym dozwolonym dla atomu.
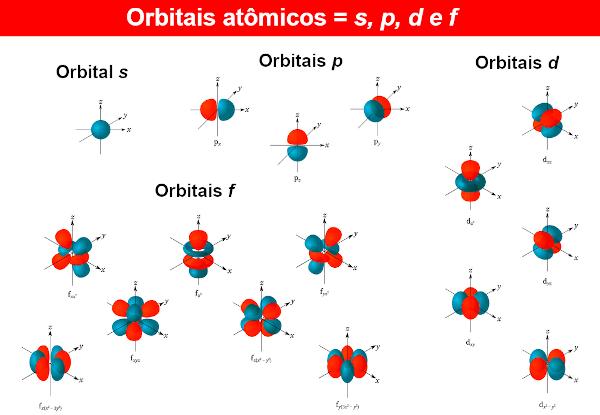
Do funkcje falowe elektronów nazywane są orbitalami atomowymi, którego wyrażenia matematyczne są również uzyskiwane przez rozwiązanie równania Schrödingera. Orbital atomowy przedstawia rozkład elektronu w atomie, czyli obszar prawdopodobieństwa istnienia elektronu w atomie. Orbitale atomowe mogą mieć różne kształty i energie, co również uzyskuje się za pomocą równania Schrödingera.
Na każdy poziom energii N (Pamiętając o tym N może być 1, 2, 3...), są N podpoziomy. Na każdym podpoziomie znajdują się orbitale o różnych kształtach. Nie ma ograniczeń co do różnych orbitali, ale przy znanych dotychczas atomach chemicy używają tylko czterech z nich, oznaczonych literami S, P, D To jest F.
Na przykład na poziomie N = 1, jest tylko jeden poziom podrzędny, więc jest tylko orbital S. A teraz poziom N = 2, istnieją dwa podpoziomy, przy czym orbitale są obecne S To jest P.
Postępy modelu atomowego Schrödingera w stosunku do innych modeli atomowych
Jak wspomniano, Schrödinger niekoniecznie przedstawił model, ale matematyczną interpretację. dla obserwowanych zjawisk dotyczących natury cząstek. Dlatego jego interpretacja staje się złożona, ponieważ samo równanie Schrödingera wymaga zaawansowanej wiedzy matematycznej do jego rozwiązania, a nawet do jego interpretacji.
Jednakże Badania Schrödingera przyniosły wielką solidność uzasadniającą energię atomów i elektronów prezenty. Na przykład rozwiązanie równania Schrödingera potwierdza model atomowy Bohra dla atomu wodoru i innych atomów hydrogenoidów (tych, które mają tylko 1 elektron). Podobnie jak Schrödinger, Bohr doszedł do dopuszczalnych poziomów energii dla atomu wodoru.
Jednak model atomowy Bohra nie jest w stanie osiągnąć poziomów elektronowych dla atomów z więcej niż 1 elektronem, a zatem wykazuje swoją główną słabość. Kiedy obecne są dwa elektrony, konieczne jest rozważenie odpychania elektronowego między nimi, parametru, który można dodać do matematycznego zrozumienia zaproponowanego przez Schrödingera.
Kolejnym ważnym punktem badań Schrödingera jest adaptacja koncepcji kwantowych, takich jak dualność cząstki, a także dokładna trajektoria elektronu. Definicja orbitalu atomowego jest bardzo ważna dla zrozumienia struktura wszystkich atomów. A gęstość prawdopodobieństwa (ψ²) pomaga nam zrozumieć, w jaki sposób elektrony zajmują orbitale atomowe w atomach polielektronowych, dostarczając bardziej szczegółowych informacji o energii elektronu.
Stefano Araujo Novais
Nauczyciel chemii
Dowiedz się więcej o budowie atomu i jego głównych cząstkach składowych: protonach, neutronach i elektronach.
Zna ewolucję modelu atomu w historii.
Kliknij i poznaj główne cechy modelu atomu Rutherforda oraz eksperyment, który umożliwił jego sformułowanie.
Dowiedz się, jakie są główne cechy, problemy iz jakich aspektów zaproponowano model atomowy Thomsona!
Wejdź i poznaj atom Bohra, który był modelem atomowym opartym na postulatach, które z powodzeniem opisywały atom wodoru.

