| TEN dyfuzja gazu to spontaniczny ruch gazu przez inny, to znaczy jego rozprzestrzenianie się w innym ośrodku gazowym. |
Ta mieszanina gazów powoduje powstanie jednorodnych mieszanin lub roztworów gazowych. Na przykład gazy wydobywające się z fabrycznych kominów lub spalin samochodowych rozchodzą się w powietrzu atmosferyczne i wraz z upływem czasu nie byliśmy już w stanie ich odróżnić, ponieważ zachodziła dyfuzja tych gazów przez powietrze.

Gazy emitowane przez kominy są rozpraszane i „giną” w powietrzu atmosferycznym, ponieważ objętość powietrza jest znacznie większa niż dymu.
| TEN wylanie gazów to szczególny rodzaj dyfuzji, w którym następuje uchodzenie gazów przez małe otwory (lub porowate ściany, które są zbiorem małych otworów). |
Na przykład balony sprzedawane dzieciom wypełnione są gazowym helem. Z biegiem czasu gaz ten przechodzi przez gumowe pory balonu, co oznacza jego wysięk. Świadczy o tym fakt, że balon opróżnia się po kilku godzinach.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Szkocki chemik Thomas Graham w 1829 roku badał to zachowanie gazów. Doszedł do wniosku, że prędkość, z jaką gaz dyfunduje lub wypływa w innym, jest związana z jego gęstością. Gdy jego dane eksperymentalne powtórzyły się dla wszystkich gazów, stworzył następujące prawo, które nosi jego imię:
Prawo Grahama: szybkość dyfuzji lub wypływu gazu jest odwrotnie proporcjonalna do pierwiastka kwadratowego jego gęstości.
Matematycznie prawo to można wyrazić równaniem:
v α 
Lub, odnosząc dwa różne gazy, mamy:
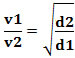
Jednostką używaną w tym przypadku jest „objętość, która ucieka w jednostce czasu”; dlatego ogólnie l/min (litry na minutę).
W ten sposób gazy o mniejszej gęstości dyfundują szybciej. Jeśli jest w tych samych warunkach temperatury i ciśnienia, możesz również powiązać to z masą molowy gazu: im większa gęstość gazu, tym większa jego masa molowa i mniejsza prędkość dyfuzja; i wzajemnie. Mamy więc:
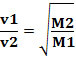
Jennifer Fogaça
Absolwent chemii
Brazylijska drużyna szkolna
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Wyglądać:
FOGAÇA, Jennifer Rocha Vargas. „Dyfuzja i wypływ gazów”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm. Dostęp 27 lipca 2021 r.