
Czasami może się zdarzyć minimalna formuła być taki sam jak wzór cząsteczkowy związku; jednak nie zawsze jest to prawdą.
Na przykład empiryczna lub minimalna formuła dla wody to H2O, co wskazuje na stosunek 2:1 między pierwiastkami, które tworzą cząsteczki wody. Przypadkowo jest to również wzór cząsteczkowy wody. Aby jednak zobaczyć, że nie zawsze tak się dzieje, spójrz na następujące dwa przykłady:
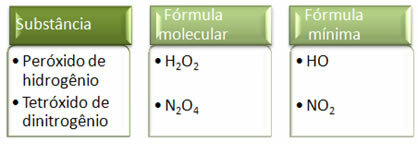
Ponieważ minimalny wzór to tylko stosunek atomów każdego pierwiastka, a nie rzeczywista ich ilość we wzorze cząsteczkowym, może wystąpić różnych związków o tym samym wzorze empirycznym, a nawet minimalny wzór związku może być taki sam jak wzór cząsteczkowy inny. Zwróć uwagę, w poniższym przykładzie, jak to się może stać:
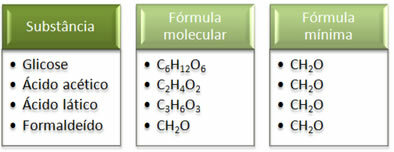
Zobacz, że minimalna formuła CH2Jest taka sama dla wszystkich substancji, to znaczy ta minimalna formuła wyraża, że we wszystkich przypadkach atomy węgla, wodoru i tlenu występują we wzorach cząsteczkowych w stosunku 1:2:1. Ponadto jedynym, który ma taki sam wzór cząsteczkowy jak wzór empiryczny, jest formaldehyd.
- Obliczanie wzoru minimum lub empirycznego:
Aby określić empiryczny wzór związku, najpierw trzeba wiedzieć, jaki jest jego procent lub przybliżony wzór. Można to zrobić mierząc masę każdego pierwiastka w 100g próbki. Tekst "Formuła procentowa lub centesimal” wyjaśnia tę sprawę lepiej.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Na przykład powiedzmy, że najbliższy skład danego związku jest określony przez: 40,00% C, 6,67% H i 53,33% O. Wartości te podajemy w gramach, biorąc pod uwagę masę 100 g próbki złożonej. Mamy więc: 40 g C, 6,67 g H i 53,33 g O.
Teraz konieczne jest przekazanie tych wartości do ilości materii (mol). Robimy to, dzieląc każdą z znalezionych wartości przez ich masy molowe:
C: 40/12 = 3,33
H: 6,67/1 = 6,67
O: 53,33/16 = 3,33
Ponieważ wartości nie są liczbami całkowitymi, posługujemy się następującym urządzeniem: wszystkie wartości dzielimy przez najmniejszą z nich, aby nie zmieniła się proporcja między nimi.
W tym przypadku najmniejsza wartość to 3,33, więc wynik będzie następujący:
C: 3,33/3,33 = 1
H: 6,67/3,33 = 2
O: 3,33/3,33 = 1
Zatem minimalna formuła tej nieznanej substancji jest równa: DO1H2O1 lub CH2O.
Krótko mówiąc, kroki potrzebne do znalezienia empirycznej lub minimalnej formuły substancji to:

Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Wzór minimalny lub empiryczny”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Dostęp 28 czerwca 2021 r.


