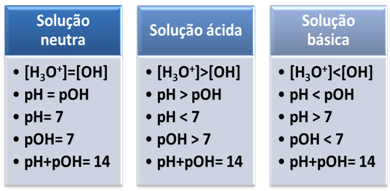
Medium jest uważane za obojętne, jeśli ma takie samo stężenie, w mol/L, jonów hydroniowych (H3O+) i wodorotlenek (OH-).
Przykładem neutralnego medium, które służy nawet jako standard dla innych roztworów, jest czysta woda destylowana o temperaturze 25ºC. W tej temperaturze ma dokładnie 1. 10-7 mol/L obu jonów. Stąd twój produkt jonowy (Kw) jest równe 10-14 (mol/L)2:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
pH i pOH podano poniżej:
pH= - log [H3O+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
To pokazuje nam, że w neutralnym rozwiązaniu pH jest równe pOH.
- Kwaśne medium:
W środowisku kwaśnym stężenie jonów H3O+ jest większa niż jonów OH-.
Takie rozwiązanie można osiągnąć dodając niewielką część jonów H3O+na przykład za pomocą kwasu.
Zgodnie z zasadą Le Chateliera, gdy w układzie będącym w równowadze wywoływane jest zakłócenie, ma on tendencję do ponownej regulacji w celu zmniejszenia skutków tej siły. Oznacza to, że jeśli do wody zostanie dodany kwas, jony H
3O+ będą w nadmiarze, a równowaga przesunie się w odwrotnym kierunku reakcji, w lewo. Więc te nadmiarowe jony będą reagować z jonami OH-. Zatem stężenie jonów OH- zmniejszy się, a roztwór stanie się kwaśny.
Iloczyn jonowy (Kw) jest zawsze równy 10-14, ale stężenie jonów H3O+ jest większe niż stężenie jonów OH-1. Dlatego pH jest większe niż pOH w środowisku kwaśnym, ale jego suma zawsze wynosi 14.
Również większe stężenie jonów H3O+, tym wyższa wartość pH. W temperaturze pokojowej (25°C), pH < 7 i pOH > 7.

- Podstawowe środki:
W środowisku podstawowym stężenie jonów OH- jest większa niż jonów H3O+.
Jeśli do wody dodamy zasadę, to znaczy, że dodajemy jony OH.- oraz, jak wyjaśniono w poprzednim punkcie, zasadą Le Chateliera, równowagą reakcji samojonizacja wody przesunie się w przeciwnym kierunku, z nadmiarem jonów reagujących z jony H3O+, zmniejszając koncentrację i czyniąc rozwiązanie podstawowym.
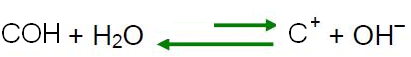
W takim przypadku pOH będzie większe niż pH. W temperaturze pokojowej (25°C), pH > 7 i pOH < 7.

Krótko:
Jennifer Fogaça
Absolwent chemii
