nazywa się Model Rutherforda propozycję atomu przedstawioną przez naukowca Ernesta Rutherforda w 1911 roku, w celu wykazania wyidealizowanego kształtu i składu składnika materii: atom.
O Model Rutherforda jest powszechnie znany jako model Układu Słonecznego, ponieważ jego strukturę i funkcjonowanie porównuje się do relacji między Słońcem a krążącymi wokół niego planetami.
W swoim modelu Rutherford porównał słońce do jądra atomu, a elektrony atomu do planet Układu Słonecznego, co widać na poniższym przedstawieniu:
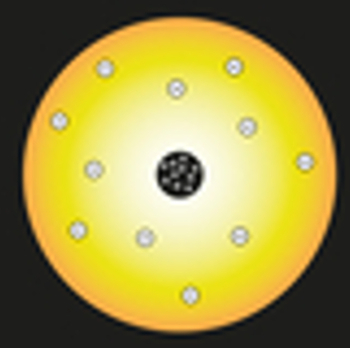
Reprezentacja modelu atomowego Rutherforda
Wewnątrz jądra byłyby umieszczone dodatnio naładowane cząstki, zwane protonami (odkryte przez Eugena Goldsteina). To jądro byłoby małe i gęste oraz miałoby największą masę atomu.
Eksperyment przeprowadzony przez Rutherforda
Wszystkie propozycje Rutherforda dotyczące stworzenia jego modelu atomowego były wynikiem eksperymentu, w którym skupił on wiązki promieniowania alfa (pochodzące z radioaktywnego polonu obecnego w ołowianym pudełku) na cienkiej złotej płycie, z metalową płytką pokrytą siarczkiem cynku z tyłu i po bokach. boki. Siarczek cynku jest solą, która po otrzymaniu promieniowania świeci.
Rutherford zauważył następnie, że podczas tego eksperymentu szczególnie świeciły trzy kropki (a, b, c):
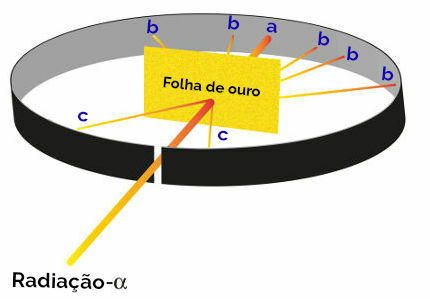
Reprezentacja eksperymentu Rutherford
punkt a (większe występowanie połysku): wskazuje, że promieniowanie alfa przeszło przez złotą płytkę bez problemu, tak jak byłoby w kierunku otworu otworu w bloku ołowianym;
punkt b (niewielkie występowanie jarzenia): wskazuje, że promieniowanie alfa przeszło przez złotą płytę, ale odbiegało podczas przechodzenia;
punkt c (niezwykle mała ilość poświaty): znajdująca się przed złotym ostrzem, wskazywała, że promieniowanie alfa nie przeszło.
Rutherford przypisał te zaobserwowane wyniki atomom tworzącym złotą płytkę, interpretując w następujący sposób:
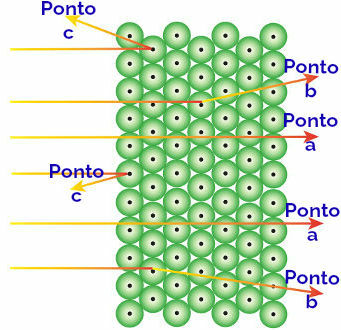
Reprezentacja zachowania promieniowania alfa i atomów
Promieniowanie alfa docierające do wskaż: promieniowanie alfa jest dodatnie i przechodzi przez obszar atomu ogromnych pustych przestrzeni. W niektórych orbitalach obecne są również elektrony.
Promieniowanie alfa docierające do punkt b: promieniowanie alfa przechodzi przez atomy złotej płytki, ale osiąga pewien moment, kiedy przechodzi blisko małego jądra atomu, który jest naładowany dodatnio, powodując odpychanie w promieniowanie.
Promieniowanie alfa docierające do punkt c: promieniowanie alfa przechodzi przez atomy złotej płyty, ale uderza w małe jądro, które jest naładowane dodatnio, powodując odpychanie promieniowania.
Problematyka modelu Rutherforda
Wielu fizyków wskazywało na pewne problemy w modelu zaproponowanym przez Rutherforda:
Pierwszy problem: jak możliwe byłoby powstanie dodatnio naładowanego jądra, gdyby dodatnio naładowane cząstki odpychały się od siebie?
Drugi problem: dlaczego elektrony w elektrosferach nie są przyciągane do protonów w jądrze?
Trzeci problem: dlaczego elektrony, które są małymi ciałami w ciągłym ruchu, nie tracą energii i nie wpadają do jądra?
* Kredyty obrazkowe: Svic / Shutterstock
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-modelo-rutherford.htm
