Analiza wolumetryczna lub wolumetria to jest procedura laboratoryjna, w której używamy określonej objętości a rozwiązanie w stężenie wiadomo, że można określić stężenie innego roztworu. Objętość roztworu o znanym stężeniu zostanie określona, gdy całkowicie przereaguje z roztworem o nieznanym stężeniu, to znaczy, że roztwory biorące udział w tym procesie muszą ze sobą reagować.
Instrumenty najczęściej używane do pomiaru danej objętości to:
- Pipeta

Przykład pipety używanej do pomiaru objętości
- Biureta

Biureta jest ważnym sprzętem do pomiaru objętości
Pomiar objętości odbywa się poprzez ocenę wysokości tzw. menisku, który jest niczym innym jak obszarem powierzchni cieczy, który ma wygląd prostokątny lub wypukły (kształt kropli), w zależności od grubości pojemnika. Im szerszy pojemnik, tym bardziej prostokątny menisk; im cieńszy pojemnik, tym bardziej będzie wypukły. Aby ocenić menisk, oko musi znajdować się dokładnie na jego wysokości i jako punkt odniesienia należy wykorzystać dolny obszar, jeśli menisk jest prostokątny, lub czubek, jeśli jest wybrzuszony. Zobacz przedstawienie oceny:
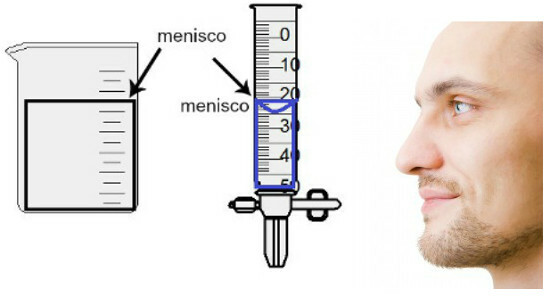
Aby ocenić łąkotkę, ważne jest, aby twoje oczy patrzyły w jej kierunku.
W analizie wolumetrycznej najczęściej używanym sprzętem jest biureta. Dzieje się tak, ponieważ ponieważ metoda obejmuje reakcje chemiczne, które można szybko przetworzyć, biureta umożliwia: ciecz uwalnia się na jej końcu w kroplach, co pozwala nam powstrzymać wyciekanie większej ilości cieczy kontrolowane.
Jedną z najczęściej stosowanych procedur w wolumetrii jest miareczkowanie. Jest to analiza wolumetryczna polegająca na wystąpieniu reakcji kwasu z zasadą lub odwrotnie. Sprzęt wymagany do jego realizacji przedstawia poniższy obrazek:
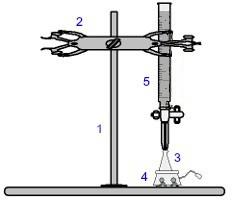
Reprezentacja sprzętu używanego w miareczkowaniu
Liczby w kolorze niebieskim oznaczają:
1) Uniwersalne wsparcie;
2) Pazur (używany do trzymania biurety);
3) Erlenmeyer (otrzymuje roztwór o nieznanym stężeniu);
4) Mieszadło magnetyczne (stosowane do mieszania roztworu obecnego w kolbie Erlenmeyera);
5) Biureta (otrzymuje roztwór o znanym stężeniu).
Do kolby Erlenmeyera dodaje się objętość roztworu o nieznanym stężeniu ze wskaźnikiem fenoloftaleiny (roztwór natychmiast zmieni kolor na różowy). W biurecie umieszcza się pewną objętość roztworu o znanym stężeniu. Następnie roztwór kwasu z biurety wkrapla się bezpośrednio do roztworu zasadowego w kolbie Erlenmeyera. Kropla trwa do momentu, gdy roztwór zasady stanie się bezbarwny, w którym to momencie nazywamy punkt zwrotny, który wskazuje, że cała zasada obecna w roztworze całkowicie przereagowała z kwasem.
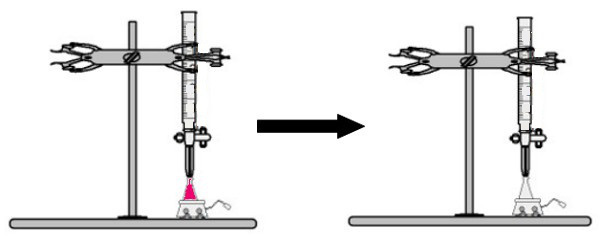
W punkcie zwrotnym roztwór nie jest już różowy i staje się bezbarwny
Obserwacja: Jeśli roztwór o nieznanym stężeniu jest kwaśny, to po otrzymaniu wskaźnika fenoloftaleiny będzie bezbarwny. Zatem punktem zwrotnym w miareczkowaniu będzie moment, w którym roztwór kwaśny zmieni kolor na różowy po otrzymaniu roztworu zasadowego z biurety.
Na koniec, aby określić stężenie roztworu podstawowego, wystarczy skorzystać z następującego równania:
Ma.Va = Mb.Vb
Ma = kwasowa molarność;
Va = objętość kwasu;
Mb = molarność podstawowa;
Vb = objętość podstawowa.
Teraz śledź przykład, w jaki sposób wykonuje się obliczenie roztworu o nieznanej molarności.
1.) 30 ml nieznanego roztworu zasady dodano do kolby Erlenmeyera w celu przeprowadzenia miareczkowania w celu określenia jego stężenia (molarności). Do biurety dodano 50 ml roztworu kwasu o stężeniu 0,2 mol/L. Po wkropleniu kwaśnego roztworu i dopóki zasadowy roztwór nie został zmiareczkowany, zaobserwowano, że do miareczkowania użyto 20 ml kwaśnego roztworu. Określ molarność użytego roztworu podstawowego.
Dane ćwiczeń:
Vb = 30 ml
Mb = ?
Ma = 0,2 mol/L
Va = 20 ml
Ponieważ molarność kwasu i jego objętość wynoszą odpowiednio 0,2 mol/l i 20 ml, a objętość użytej zasady to 30 ml, wystarczy zastosować wzór miareczkowania:
Ma.Va = Mb.Vb
0,2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol/L
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm
