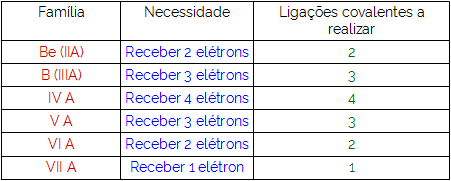
Jednym ze sposobów organizacji pierwiastków chemicznych są rodziny, które odpowiadają pionowym sekwencjom układu okresowego.
W 18 kolumn tabeli pogrupuj pierwiastki według podobieństwa właściwości chemicznych.
Porządkowanie pierwiastków chemicznych w rodziny było praktycznym sposobem na uporządkowanie różnych znalezionych informacji i przedstawienie ich w prosty sposób.
Aby ułatwić lokalizację pierwiastka chemicznego, rodziny oznaczono liczbami od 1 do 18, jak pokazano poniżej:
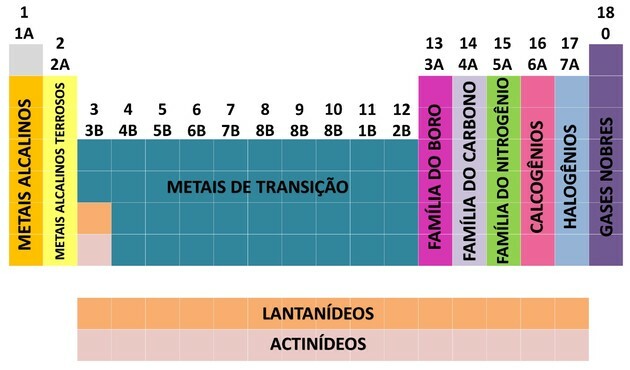
Dzięki wkładowi wielu naukowców i różnym próbom uporządkowania danych układ okresowy ewoluował, ustanawiając porządek uporządkowania pierwiastków.
Nomenklatura rodzin
- Rodziny w tabeli zostały podzielone na A (reprezentatywne) i B (przejściowe), identyfikowane za pomocą liter i cyfr.
- ty Reprezentatywne elementy rodziny 0, 1A, 2A, 3A, 4A, 5A, 6A i 7A odpowiadają.
- ty elementy przejściowe rodziny 1B, 2B, 3B, 4B, 5B, 6B, 7B i 8B odpowiadają.
- Zgodnie z ustaleniami Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC), rodziny zostały zidentyfikowane w grupy od 1 do 18.
Układ okresowy i dystrybucja elektroniczna
Podobieństwa między elementami tej samej rodziny występują, ponieważ liczba elektronów walencyjnych atomu w stanie podstawowym jest taka sama dla członków pewnej grupy.
Na przykład:
| Grupa 1 | Dystrybucja elektroniczna |
|---|---|
| 3czytać | 2-1 |
| 11W | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Atomy grupy 1 mają swoje elektrony rozmieszczone na więcej niż jednym poziomie energii, ale wszystkie mają elektron walencyjny.
Dzięki temu obserwujemy, że czyniąc dystrybucja elektroniczna atomu w stanie podstawowym znajdujemy jego pozycję w układzie okresowym.
Reprezentatywne elementy
Reprezentatywne pierwiastki wykazują stosunkowo mniej złożone zachowanie chemiczne niż pierwiastki przejściowe i tworzą większość otaczających nas substancji.
Niektórym reprezentatywnym rodzinom elementów nadawane są specjalne nazwy, jak pokazano poniżej:
Grupa |
Rodzina | konkretna nazwa | Pochodzenie nazwy | Elementy | elektroniczna Konfiguracja |
|---|---|---|---|---|---|
| 1 | 1A | metale alkaliczne | z łaciny alkalia, co oznacza „szary roślin”. | Li, Na, K, Rb, Cs i Fr | nas1 |
| 2 | 2A | metale ziem alkalicznych | Termin „ziemski” odnosi się do „istniejącego na ziemi”. | Be, Mg, Ca, Sr, Ba i Ra | nas2 |
| 13 | 3A | rodzina borowa | Nazwa pierwszego elementu rodziny. | B, Al, Ga, In, Tl i Nh. | nas2np1 |
| 14 | 4A | rodzina węgla | Nazwa pierwszego elementu rodziny. | C, Si, Ge, Sn, Pb i Fl. | nas2np2 |
| 15 | 5A | Rodzina azotowa | Nazwa pierwszego elementu rodziny. | N, P, As, Sb, Bi i Mc. | nas2np3 |
| 16 | 6A | Chalkogeny | z greckiego kredy, ponieważ są to pierwiastki występujące w rudach miedzi. | O, S, Se, Te, Po i Poz. | nas2np4 |
| 17 | 7A | Halogeny | Greckie wyrażenie oznaczające substancje tworzące sól. | F, Cl, Br, I, At i Ts. | nas2np5 |
| 18 | 0 | Gazy szlachetne | Uznano, że nie reaguje z innymi substancjami. | He, Ne, Ar, Kr, Xe, Re i Og. | 1s2 (On) lub my2np6 |
Poprzez tabelę widzimy, że:
- Przedstawione powyżej pierwiastki są klasyfikowane jako reprezentatywne, ponieważ mają najbardziej energetyczny elektron na podpoziomie s lub p.
- Elektrony są rozmieszczone na poziomach energetycznych, a n reprezentuje najbardziej zewnętrzny poziom atomu w stanie podstawowym.
- Reprezentatywne elementy, zgodnie z zaleceniem IUPAC, należą do grup lub rodzin 1,2,13,14,15,16,17 i 18.
O wodór jest klasyfikowany poza innymi elementami. Nawet przy konfiguracji elektronicznej 1s1, nie należy do grupy 1 za prezentowanie pojedynczego zachowania.
elementy przejściowe
Elementy przejściowe odpowiadają grupom od 3 do 12. Otrzymują tę nazwę, ponieważ mają właściwości pośrednie między grupami 1 i 2 a reprezentatywnymi pierwiastkami niemetalicznymi.
ty metale przejściowe są zdefiniowane przez IUPAC jako:
Element przejściowy ma niepełny podpoziom d lub może tworzyć kationy z niepełnym podpoziomem d.
Kiedy najbardziej energetyczny elektron atomu stanu podstawowego znajduje się na niepełnym podpoziomie d, charakteryzuje się to jako przejście zewnętrzne.
Lantanowce i aktynowce są wewnętrznymi pierwiastkami przejściowymi, ponieważ mają co najmniej jeden niepełny podpoziom f.
Gdy pierwiastki mają elektrony, które wypełniają orbitale d lub f, wykazują podobne właściwości i można je zaklasyfikować do pierwiastków przejście zewnętrzne lub wewnętrzne.
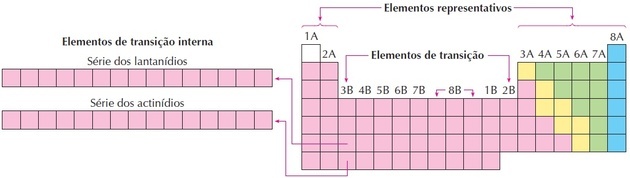
Jak widać na obrazku, rodzina 8B odpowiada 3 kolumnom, są to grupy 8, 9 i 10, które zostały pogrupowane w ten sposób, ponieważ mają podobne cechy.
Główne cechy rodzin
Poniższa tabela przedstawia główne właściwości grup w układzie okresowym:
| Grupa | funkcje | substancje złożone bardziej powszechne |
zdarzenia |
|---|---|---|---|
| 1 | Solidny i lśniący w warunkach otoczenia. Bardzo reaktywne, miękkie i dobre przewodniki prądu. | Sole, wodorotlenki i tlenki |
Reaguj z halogenami i twórz sole. |
| 2 | Mniej reaktywny i trudniejszy niż grupa 1. Srebro stałe o dobrej przewodności. | Sole, wodorotlenki i tlenki |
Tworzenie soli i tlenków. |
| 3 do 12 | Tworzą kompleksy. Są to ciała stałe metaliczne, twarde i kruche, z wyjątkiem rtęci, która jest cieczą. | Sole, tlenki i kompleksy. Np.: AgNO3, TiO i [Cr(OH)3(H2O)3] |
W minerałach w postaci tlenków. |
| 13 | Substancje stałe w warunkach otoczenia, srebro z wyjątkiem boru. | Tlenki Np.: B2O3 |
W minerałach w postaci tlenków. |
| 14 | Solidny w warunkach otoczenia. | Atomy C i Si mogą układać się w łańcuchy i wytwarzać ogromną różnorodność substancji. | W organizmach żywych oraz w postaci krzemianów lub tlenków. |
| 15 | Ciała stałe, z wyjątkiem azotu, który w warunkach otoczenia jest gazem. | Tlenki i kwasy Np. NIE2 i H3KURZ4 |
Atmosfera, organizmy żywe i minerały. |
| 16 | Ciała stałe, z wyjątkiem tlenu, który w warunkach otoczenia jest gazem. | Siarczki i tlenki Np.: ZnS i SiO2 |
Atmosfera, organizmy żywe i minerały. |
| 17 | Tworzą cząsteczki dwuatomowe i są bardzo reaktywne. Są złymi przewodnikami elektryczności i ciepła. Są agresywne dla żywych istot i środowiska. | Kwasy i sole. Np.: HCl i KBr |
są obecne w substancjach organiczne i mineralne. |
| 18 | Są bardzo stabilne i występują w postaci gazów. | Prawie nie tworzą substancji złożonych. | Gazy w atmosferze. |
Właściwości chemiczne i fizyczne odróżniają jedną rodzinę od drugiej. Jak widzieliśmy, właściwości chemiczne są związane z elektrony wartościowości, a za ich pośrednictwem atom oddziałuje z innym, będąc odpowiedzialnym za zachowanie chemiczne i wiązania chemiczne utworzone.
Właściwości fizyczne pierwiastków z tej samej grupy mogą się różnić w zależności od liczby atomowej i masy.
Ćwiczenia
Teraz, gdy wiesz trochę więcej o rodzinach układu okresowego pierwiastków, sprawdź swoją wiedzę i zobacz, czego się nauczyłeś.
1) Rozważ następujący wyciąg z układu okresowego.
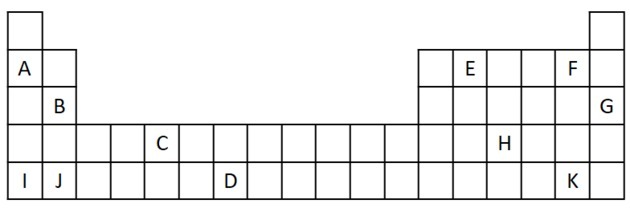
a) Wymień dwa pierwiastki, które mają dwa elektrony walencyjne.
b) Wskazać pierwiastek, który gwałtownie reaguje z wodą, wytwarzając wodorotlenek metalu.
c) Wskaż element niereaktywny.
d) Wskaż dwa pierwiastki, które łączą się z metalami alkalicznymi, tworząc sole.
Odpowiadać:
a) B i J
Dwa elektrony walencyjne odpowiadają grupie 2, która ma konfigurację elektronów ns2 i są reprezentowane w ćwiczeniu przez B i J.
b) A, B, I lub J.
A i I reprezentują elementy rodziny 1; B i J pochodzą z rodziny 2. Jak widzieliśmy w tabeli właściwości pierwiastki z grupy 1 i 2 są bardzo reaktywne i mogą tworzyć wodorotlenki, jak w podanych przykładach: KOH i Mg (OH)2.
c) G
Gazy szlachetne są bardzo stabilne i dlatego mało reaktywne. Litera G jest wstawiana do tabeli jako element tej rodziny.
d) F i K
Halogeny reagują z metalami alkalicznymi tworząc sole. Najczęstszym tego przykładem jest sól kuchenna, NaCl.
2) Poniższy rysunek przedstawia trzy pierwiastki chemiczne, od lewej do prawej, lit, sód i potas.

Wybierz opcję, która poprawnie uzupełnia każdą z poniższych instrukcji.
1.1) "Możemy powiedzieć, że lit, sód i potas...
(A) … należą do tego samego okresu.”
(B) … ma taką samą liczbę atomową.”
(C) … należą do tej samej grupy.”
(D) …ma taką samą liczbę masową.”
1.2) "Pierwiastki lit, sód i potas...
(A) …ma bardzo podobne właściwości chemiczne.”
(B) … ma bardzo różne właściwości chemiczne.”
(C) … są niemetalami.”
(D) … reagują z wodą, tworząc kwaśne roztwory.”
Odpowiedzi:
1.1) (C) należą do tej samej grupy.
1.2) (A) ma bardzo podobne właściwości chemiczne.
Informacje te możemy uzyskać, konsultując układ okresowy pierwiastków lub dokonując elektronicznego rozmieszczenia pierwiastków litu, sodu i potasu. Zobaczymy, że te trzy mają elektron w powłoce walencyjnej, a ponieważ należą do tej samej grupy, właściwości chemiczne są bardzo podobne.
3) Rozważ poniższą tabelę, w której przedstawione są liczby atomowe i rozkłady elektronowe niektórych pierwiastków chemicznych.
| Element | symbol chemiczny | Liczba atomowa | Dystrybucja elektroniczna |
|---|---|---|---|
| Lit | czytać | 3 | 2,1 |
| Beryl | być | 4 | 2,2 |
| Fluor | fa | 9 | 2,7 |
| neon | Huhu | 10 | 2,8 |
| chlor | Cl | 17 | 2,8,7 |
| argon | Powietrze | 18 | 2,8,8 |
| Potas | K | 19 | 2,8,8,1 |
| Wapń | Tutaj | 20 | 2,8,8,2 |
Wskaż grupę każdego elementu.
Odpowiadać:
Lit i potas: grupa 1. (Mają elektron w powłoce walencyjnej).
Beryl i wapń: grupa 2. (Mają dwa elektrony w powłoce walencyjnej).
Fluor i chlor: grupa 17. (Mają siedem elektronów w powłoce walencyjnej).
Neon i argon: grupa 18. (Mają osiem elektronów w powłoce walencyjnej).
Sprawdź pytania egzaminacyjne z komentowanym rozwiązaniem w Ćwiczenia z układu okresowego pierwiastków oraz niepublikowane pytania na ten temat w Ćwiczenia z organizacji układu okresowego pierwiastków.