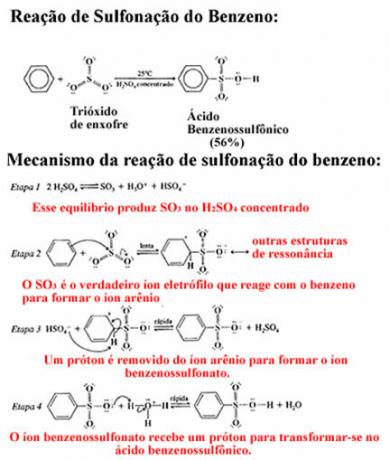
Związki cząsteczkowe lub kowalencyjne są tworzone przez wiązania kowalencyjne, czyli tych, w których nie mamy udziału metali (z wyjątkiem berylu) w ich powstawaniu. Tak więc w tego typu wiązaniu wszystkie atomy muszą otrzymywać elektrony i dlatego zawsze będą się nimi dzielić.
TEN formuła strukturalna jest jednym ze sposobów przedstawiania podziału elektronów między atomami związków molekularnych. Abyśmy mogli przeprowadzić zestawianie wzoru strukturalnego, konieczne jest, abyśmy przede wszystkim wiedzieli, jaka jest potrzeba każdego z elementów wchodzących w skład związku zgodnie z according teoria oktetów. Poniższa tabela pokazuje zapotrzebowanie na każdy zaangażowany element zgodnie z jego rodziną:

Z wyrażonych powyżej potrzeb powinniśmy wiedzieć, że dzięki zbudować wzór strukturalny, jako zasoby mamy tylko następujące narzędzia:
• wiązanie pojedyncze: − (współdzielenie dwóch elektronów);
• wiązanie podwójne: = (podział czterech elektronów);
• wiązanie potrójne: ≡ (współdzielenie sześciu elektronów);
Znajomość potrzeb i narzędzi, składanie wzoru strukturalnego związku cząsteczkowego można wykonać krok po kroku:
a) Cząsteczka dwuatomowa (złożona tylko z dwóch atomów):
Po prostu napisz atom po lewej i atom po prawej i umieść wiązanie, które odpowiada potrzebom obu. Zobacz kilka przykładów:
- O2
Ponieważ tlen należy do rodziny VIA, potrzebuje dwóch elektronów. Dlatego wiązaniem, które najlepiej pasuje między nimi, jest wiązanie podwójne.

- HCl
Ponieważ H i Cl potrzebują tylko jednego elektronu, wiązanie, które najlepiej pasuje między nimi, jest proste.

b) Cząsteczki, które mają więcej niż dwa atomy
W związkach molekularnych, które mają więcej niż dwa atomy, musimy umieścić w centrum cząsteczki atom, który potrzebuje największej liczby wiązań (priorytet) lub najmniej elektroujemny atom. Pozostałe muszą znajdować się na czterech biegunach (północnym, południowym, wschodnim i zachodnim). Umieszczając połączenie między każdym z nich, musimy nadać priorytet atomom znajdującym się na biegunach. Centralny atom zawsze będzie ustabilizowany zgodnie z tą kolejnością składania. Zobacz kilka przykładów:
- H2O
Ponieważ tlen potrzebuje więcej wiązań (dwóch, ponieważ należy do rodziny VIA), zostanie umieszczony w centrum cząsteczki, a wodory na biegunach. Ponieważ potrzeba dla każdego H to tylko jedno łącze dla każdego z nich, użyjemy prostego łącza. Ponieważ tlen tworzy dwa pojedyncze wiązania, będzie stabilny.

Teraz nie przestawaj... Po reklamie jest więcej ;)
- NH3
Ponieważ azot potrzebuje więcej wiązań (trzy, ponieważ należy do rodziny VA), zostanie umieszczony w centrum cząsteczki, a wodory na biegunach. Ponieważ zapotrzebowanie na każdy wodór to tylko jedno wiązanie dla każdego z nich, użyjemy pojedynczego wiązania. Ponieważ tlen tworzy trzy pojedyncze wiązania, będzie stabilny.

- CH4
Ponieważ węgiel potrzebuje więcej wiązań (cztery, jak z rodziny VIA), zostanie umieszczony w centrum cząsteczki, a wodory na biegunach. Ponieważ zapotrzebowanie na każdy wodór to tylko jedno wiązanie dla każdego z nich, użyjemy pojedynczego wiązania. Ponieważ węgiel utworzy cztery pojedyncze wiązania, będzie stabilny.

- CO2
Ponieważ węgiel potrzebuje więcej wiązań (4, ponieważ należy do rodziny IVA), zostanie umieszczony w centrum cząsteczki, a tlen na biegunach. Ponieważ potrzeba każdego O to dwa wiązania dla każdego z nich, użyjemy wiązania podwójnego. Ponieważ tlen tworzy dwa podwójne wiązania, będzie stabilny.

Obserwacja: Gdy atom cząsteczki podczas składania wzoru strukturalnego jest stabilny, a inny nadal potrzebuje dwóch elektronów możemy użyć innego narzędzia, które nazywa się współrzędnym wiązaniem kowalencyjnym celownik. Ten rodzaj wiązania może być stosowany tylko pod tym warunkiem (jeden atom stabilny, a drugi wymagający dwóch elektronów). Zobacz kilka przykładów:
- CO
Ponieważ mamy tylko dwa atomy, umieśćmy jeden po lewej, a drugi po prawej. Tlen potrzebuje dwóch wiązań, więc musimy użyć wiązania podwójnego.

Jednak przy użyciu pary tlen jest stabilny, a węgiel potrzebuje jeszcze dwóch elektronów. Dlatego możemy użyć celownikowego wiązania kowalencyjnego, które jest reprezentowane przez strzałkę, która zawsze przechodzi od stabilnego do niestabilnego atomu.

- O3
Ponieważ mamy trzy atomy, jeden z tlenów musi znajdować się w centrum cząsteczki, a dwa pozostałe na biegunach. Badana reguła zawsze wymaga, aby w takich przypadkach najpierw umieścić wiązania w atomach na biegunach. Jednak tutaj możemy dodać tylko jedno podwójne, ponieważ wszystkie tlenki tworzą tylko dwa wiązania.

Tlen w środku jest stabilny, podczas gdy tlen po lewej wciąż potrzebuje dwóch elektronów. Z tego powodu możemy użyć linku celownika, aby go ustabilizować.

Przeze mnie Diogo Lopes Dias