Kiedy mieszają się dwa roztwory, niezależnie od tego, czy są różne, czy nie, należy najpierw przeanalizować, czy między nimi zachodzi reakcja. Na przykład, jeśli zmieszamy roztwór wody z cukrem (wodny roztwór sacharozy) z roztworem wody z solą (solanką), uzyskamy mieszanie roztworów bez reakcji chemicznych.
To samo dzieje się, gdy zmieszamy dwa roztwory chlorku sodu (NaCl) o różnych stężeniach. W tym przypadku również nie będzie reakcji. Możemy wtedy zdefiniować ten przykład jako a mieszanie roztworów tej samej substancji rozpuszczonej bez jakiejkolwiek reakcji chemicznej, gdzie pierwszym przykładem jest a mieszanie roztworów różnych substancji rozpuszczonych, bez reakcji chemicznej.
W obu przypadkach skład chemiczny składników roztworów nie ulegnie zmianie.jednak niektóre aspekty ilościowe będą musiały zostać ponownie obliczone.
Aby zrozumieć, jak możemy określić stężenie molowe (Molarność) i wspólne stężenie mieszaniny roztworów bez reakcji, zobaczmy rozwiązanie dwóch wspomnianych przypadków:
1.) Mieszanina roztworów tej samej substancji rozpuszczonej, bez wystąpienia reakcji chemicznej:

Wyobraź sobie, że mieszamy dwa roztwory chlorku sodu, jeden o stężeniu 2,0 g/lw 60,0 ml roztworu, a drugi o stężeniu 2,5 g/lw 80 ml objętości roztworu.
Ponieważ nie zachodzi żadna reakcja, zarówno masa, jak i objętość są tylko sumą początkowych mas i objętości:
m (rozwiązanie) = m1 (NaCl) + m2 (NaCl)
mi1 (NaCl) = v. Cm2 (NaCl) = v. DO
mi1 (NaCl) = 0,06L. 2,0 g/l m2 (NaCl) = 0,08 l. 2,5 g/l
mi1 (NaCl) =0,1 gm2 (NaCl) = 0,2 g
m (roztwór) = 0,1 g + 0,2 g
m (roztwór) = 0,3 g
v (rozwiązanie) = v1 (NaCl) + v2 (NaCl)
v (roztwór) = (60 + 80) ml
v (roztwór) =140 ml = 0,14 l
Stężenie można następnie uzyskać, korzystając z tych danych:
C (rozwiązanie) = m (rozwiązanie)
v (rozwiązanie)
C (rozwiązanie) = 0,3 g
0,14L
C (rozwiązanie)≈ 2,14 g/L
2.) Mieszanina roztworów różnych substancji rozpuszczonych, bez występowania reakcji chemicznej:
Weźmy na przykład mieszaninę 500 ml wodnego roztworu sacharozy (C12H22O11), który początkowo miał stężenie 18,0 g/L, z 1 L roztworu słonej wody (roztwór wodny chlorku sodu – NaCl) o stężeniu 100,0 g/L.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Jaka stała się po zmieszaniu molarność, wspólne stężenie, masa i objętość roztworu powstałego z mieszaniny?
Ponieważ nie było reakcji chemicznej, masy C12H22O11 a NaCl pozostają niezmienione. A początkowe wartości masy można osiągnąć za pomocą prostej zasady trzech przy użyciu stężeń reakcji.
18,0 g 1 l
m (C12H22O11) 0,5L
m (C12H22O11) = 9,0 g
m (NaCl) 100,0 sol
Masę można również osiągnąć według wzoru:
m = v. DO
m (C12H22O11) = 0,5 l. 18g/L
m (C12H22O11) = 9,0 g
m (NaCl) = 1 l. 100,0 g/l
m (NaCl) = 100,0 g
Zatem całkowita masa roztworu jest sumą dwóch mas:
m (roztwór) = m (C12H22O11) + m (NaCl)
m (roztwór) = 109,0 g
Objętość jest po prostu sumą początkowych objętości, więc mamy:
v (rozwiązanie końcowe) = v (C12H22O11) + v (NaCl)
v (rozwiązanie końcowe) = (0,5 + 1)L
v (rozwiązanie końcowe) = 1,5L
Stężenie końcowe uzyskuje się przez oddzielne obliczenie stężeń każdej z substancji rozpuszczonych. Ponieważ nie reagują ze sobą, a ich masy nie zmieniają się, możemy zastosować następujący wzór na stężenie:
C = mi
v
początkowy = mInicjał końcowe c = mFinał
vInicjał vFinał
miInicjał = mFinał
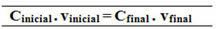
C (C12H22O11) =?
DOInicjał. vInicjał = CFinał. vFinał
18,0 g/l. 0,5 l = CFinał 1,5 litra
C (C12H22O11) Finał = 6,0 g/l
C(NaCl)=?
DOInicjał. vInicjał = CFinał. vFinał
100,0 g/l. 1 l = C końcowa .1,5 l
C (NaCl)Finał = 66,67 g/l
Zależność sporządzoną dla tego wzoru wspólnego stężenia można również wykorzystać do obliczenia molarności (Mja. vja = Mfa. vfa) oraz dla stężenia masowego (tytuł - Tja. vja = Tfa. vfa).
Jennifer Fogaça
Absolwent chemii