Główną cechą wyróżniającą reakcje redoks jest to, że jednocześnie jeden rodzaj chemiczny traci elektrony (poprzez utlenianie), a inny zyskuje elektrony (poprzez redukcję).
Jednak w niektórych reakcjach można zaobserwować, że występuje nie tylko utlenianie i/lub redukcja. Poniżej przykład:
SnS + HCl + HNO3 → SnCl4 + S + NIE + H2O
Obliczając stopnie utlenienia (Nox) wszystkich atomów w tej reakcji, zgodnie z treścią „Wyznaczanie liczby utlenienia (Nox)”, otrzymujemy:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NIE + H2O
Sprawdźmy teraz, któreSubstancje ulegały zmianom w ich Nox, a w konsekwencji utleniały się i zmniejszały:
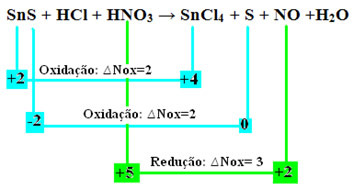
Zauważ, że wystąpiły dwa utleniania. Jak w takim razie zbilansować równanie chemiczne?
Jedną ważną rzeczą, o której należy pamiętać, która dotyczy wszystkich reakcji redoks, jest to, że liczba oddanych elektronów musi zawsze równać się liczbie otrzymanych elektronów.
Dlatego, aby zrównoważyć tego typu reakcję, postępuj zgodnie z tymi samymi zasadami ustalonymi w tekście ”
Równoważenie redoks”, jednak z tylko jedną zmianą: określenie zmienności Nox (∆Nox) form, które wygenerowały dwa utleniania (SnS) będzie sumą dwóch ∆Nox, co da nam całkowitą wartość utraconych elektronów:- SnS: ∆Całkowite Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Całkowity NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Możemy więc wykonać następujące kroki w celu wyważenia:
Teraz nie przestawaj... Po reklamie jest więcej ;)
- SnS: ∆Całkowity NOx = 4 → 4 będzie współczynnikiem HNO3;
- HNO3: ∆Nox = 3 → 3 będzie współczynnikiem SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NIE + H2O
Kontynuacja wyważania metodą próbną:
- Ponieważ masz 3 Sn i 3 S w pierwszym elemencie, będą to również twoje współczynniki w drugim elemencie:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 T+NIE+H2O
- Dzięki temu drugi członek został z 12 Cl (3. 4 = 12), więc 12 będzie współczynnikiem substancji, w której znajduje się Cl w pierwszym elemencie, czyli HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NIE + H2O
- Mamy teraz 16 H w pierwszym elemencie (12 + 4 = 16), stąd współczynnik H2O będzie równe 8, ponieważ 8 pomnożone przez wskaźnik wodoru, który wynosi 2, daje 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NIE +8h2O
- Ponadto w pierwszym pręcie jest również 4 N, więc 4 będzie również współczynnikiem N w drugim pręcie:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO + 8 H2O
Zwróć uwagę, że ilość tlenu w pierwszej kończynie (3. 4 = 12) jest równe całkowitej ilości tego pierwiastka w drugiej kończynie (4 + 8 = 12). Więc reakcja jest zrównoważona.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Wyglądać:
FOGAÇA, Jennifer Rocha Vargas. „Reakcje z więcej niż jednym utlenianiem i/lub redukcją”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Dostęp 27 lipca 2021 r.


