Alotropia to zjawisko, które występuje, gdy ten sam pierwiastek chemiczny ma właściwość tworzenia więcej niż jednej prostej substancji.. Te odmiany alotropowe mogą się różnić ze względu na liczbę atomów pierwiastka związanych ze sobą w cząsteczce lub ze względu na rozmieszczenie atomów w sieci krystalicznej.
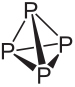
Jednym z pierwiastków, które mają odmiany alotropowe, jest fosfor (P), najczęstszym z nich jest biały fosfor to jest czerwony fosfor. Te dwa alotropy fosforu różnią się nie odmiennym układem przestrzennym, ponieważ oba składają się w zasadzie z czworościennych cząsteczek, ale ilość atomów fosforu jest inna w każdym z nich.
Zobacz skład i główne cechy fosforu białego i czerwonego:
- Fosfor biały:
Wzór cząsteczkowy białego fosforu to P4, co oznacza, że jego cząsteczki składają się z czterech atomów fosforu.

Ten typ luminoforu jest niezwykle reaktywny, głównie ze względu na napięcie między jego wiązaniami pod kątem 60°. Jest tak reaktywny, że trzeba go przechowywać w wodzie, aby nie miał kontaktu z powietrzem i nie eksplodował. Należy zachować szczególną ostrożność podczas obchodzenia się z nim, ponieważ powoduje poważne oparzenia skóry i zatrucia w przypadku połknięcia (tylko 0,1 g połkniętego białego fosforu może prowadzić do śmierci).
Jak widać poniżej, biały fosfor jest białym woskowym ciałem stałym.
Teraz nie przestawaj... Po reklamie jest więcej ;)

Fosfor biały przechowywany w wodzie, aby nie miał kontaktu z powietrzem*
Po podgrzaniu przy braku powietrza biały fosfor zamienia się w czerwony fosfor.
- czerwony fosfor:
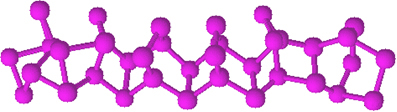
Fosfor czerwony nie ma określonej struktury, ale istnieją dowody na to, że jest to makrocząsteczki powstałe w wyniku wiązania wspomnianych struktur czworościennych (P4), reprezentowany przez PNie.
Jest znacznie mniej reaktywny niż biały fosfor, jednak po potarciu może się zapalić. Dlatego stosuje się go na bocznych powierzchniach pudełek zapałek. Kiedy pocieramy wykałaczką o powierzchnię pudełka, zapałka zapala się, a następnie zapala wysoce łatwopalny materiał na główce wykałaczki.
W niektórych krajach zapałkę umieszcza się na główce wykałaczki w postaci litery P.4s3.
Czerwony fosfor jest proszkiem amorficznym, to znaczy nie ma struktury krystalicznej i ma kolor ciemnoczerwony, jak pokazano poniżej:

Czerwony proszek fosforowy.
* Autorstwo obrazu należy do W. Oelena i można ją znaleźć tutaj.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Alotropia fosforu”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm. Dostęp 28 czerwca 2021 r.
Chemia
Czym jest alotropia, proste substancje, tlen gazowy, ozon, formy alotropowe, tlen pierwiastkowy, promienie ultrafioletowe od słońca, diament, grafit, atomowość, biały fosfor.