Adsorpcja to fizykochemiczna właściwość cząsteczek substancji ciekłych, gazowych i stałych.
Proces ten zachodzi, gdy cząstki ciekłe lub gazowe zostają uwięzione na powierzchni ciał stałych. Jeśli ciała stałe są porowate, zdolność adsorpcji wzrasta jeszcze bardziej.
Istnieją dwie klasyfikacje komponentów biorących udział w procesie:
- Adsorbaty: Jest to substancja ciekła lub gazowa zatrzymywana na powierzchni adsorbentu stałego.
- Adsorbenty: Jest to substancja stała, która sprzyja zatrzymywaniu innych substancji.
TEN desorpcja jest to odwrotny proces adsorpcji, czyli uwalnianie adsorbatu z powierzchni adsorbentu.
Rodzaje
W zależności od charakteru sił zaangażowanych w proces, adsorpcja może być dwojakiego rodzaju: sorpcja fizyczna i chemisorpcja.
W niektórych przypadkach oba typy adsorpcji mogą wystąpić w tym samym procesie.
fizjsorpcja
Fizyczna sorpcja fizyczna lub adsorpcja między adsorbatem a adsorbentem zachodzi dzięki siłom Van der Waallsa (dipol-dipol lub indukowany dipol).
W tym przypadku nie ma rodzaju zmiany molekularnej w substancjach biorących udział w procesie. Oznacza to, że substancja zachowuje swój charakter chemiczny.
Adsorpcja fizyczna jest procesem odwracalnym.
Chemisorpcja
Chemisorpcja lub adsorpcja chemiczna składa się z Reakcja chemiczna. Angażując elektrony, jest uważany za silniejsze wiązanie chemiczne niż fizjsorpcja.
W chemisorpcji zachodzi molekularna zmiana substancji biorących udział w procesie. Oznacza to, że substancję można przekształcić w inną.
Ponieważ jest to reakcja chemiczna, składniki adsorbentu i adsorbatu muszą mieć specyficzność. Muszą być w stanie rozpoznać i zareagować.
Adsorpcja chemiczna jest procesem nieodwracalnym.
Przeczytaj także o:
- Siły międzycząsteczkowe
- Wiązania chemiczne
Adsorpcja i absorpcja
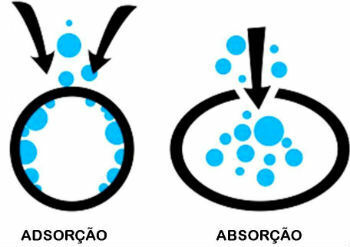
Różnica między adsorpcją a absorpcją
Adsorpcja i absorpcja to dwa różne procesy. Poznaj różnicę między nimi:
- adsorpcja: Substancja pozostaje jednak na powierzchni innej, nie będąc częścią jej objętości.
- Wchłanianie: Jedna substancja jest wchłaniana przez inną, powodując zmianę objętości.
Typowym przykładem absorpcji jest gąbka pochłaniająca wodę. W ten sposób objętość wody jest włączana do objętości gąbki.
Węgiel aktywny
Węgiel aktywny jest przykładem lepiej znanej substancji adsorbującej. W jego strukturze znajdują się liczne pory, które intensyfikują retencję substancji i zwiększają ich zdolność adsorpcji.
Dlatego węgiel aktywny służy do usuwania substancji organicznych, olejów, kolorów i zapachów. Wykorzystywany jest również do uzdatniania wody oraz produkcji kosmetyków i leków.

Węgiel aktywny
Przeczytaj też:
- Chromatografia
- Separacja mieszanin
- Solute i Solvent
- Materiały używane w laboratorium chemicznym