W wiązania kowalencyjne, nazywany również wiązania molekularne lub homopolarne, to te, które występują między atomami pierwiastki elektroujemne, czyli z tendencją do przyjmowania elektronów, tworząc wiązanie dzielą elektrony z ich powłok walencyjnych.
Wiązanie kowalencyjne może wystąpić pomiędzy następującymi elementami: wodór, niemetale i półmetale. Metale nigdy nie uczestniczą w tego rodzaju wiązaniu.
Rozważmy prosty przykład wiązania kowalencyjnego: wiązanie tworzące gaz wodorowy (H2):
H + H → H2
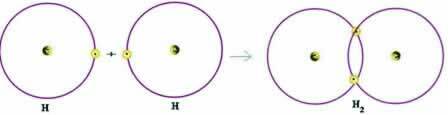
Zauważ, że oba atomy musiały otrzymać elektron, aby skompletować powłokę walencyjną – zgodnie z regułą oktetu – i w ten sposób zachować stabilność. Dzielili się więc swoimi elektronami iw ten sposób obaj mieli po dwa elektrony, mieli pełną powłokę K i nabyli konfigurację helu z gazu szlachetnego.
To współdzielenie elektronów jest tym, co odróżnia ten rodzaj wiązania od wiązania jonowego, w którym zachodzi przeniesienie elektronów.
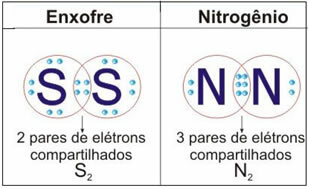
Zobacz poniższy rysunek, aby zobaczyć jeszcze dwa przykłady tego przypadku:
Teraz nie przestawaj... Po reklamie jest więcej ;)
W tym typie wiązania dochodzi do tworzenia cząsteczek, które można przedstawić za pomocą ich odpowiednich wzory molekularne, czyli najprostsza reprezentacja, która wskazuje, ile atomów każdego pierwiastka znajduje się w cząsteczce. Niektóre przykłady wzorów cząsteczkowych to: H2, S2, O2, nie2, H2O, CO2itp.
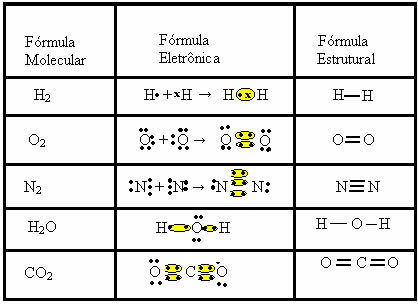
Wiązanie kowalencyjne można przedstawić za pomocą dwóch innych wzorów:
- Formuła elektroniczna lub formuła Lewisa: w tym wzorze pojawiają się również elektrony powłoki walencyjnej każdego atomu i tworzenie par elektronowych. Te elektrony są symbolizowane przez znaki . lub x;
- Płaski wzór strukturalny lub wzór strukturalny coupera: pokazuje linki elementów, z każdą wspólną parą odpowiadającą myślnikowi. Jeśli to tylko myślnik, nazywamy to pojedynczym łączem; jeśli są dwa, podwójne wiązanie; a jeśli są trzy kreski, potrójne wiązanie.
Spójrz na inne przykłady wiązań kowalencyjnych reprezentowanych przez te trzy wzory chemiczne:
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. "Wiązania kowalencyjne"; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Dostęp 27 czerwca 2021 r.