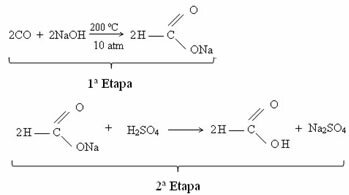
Atom lub jon straci elektrony tylko wtedy, gdy otrzyma wystarczającą ilość energii, która jest energią jonizacji.
W praktyce najważniejsze jest: pierwszy potencjał jonizacyjny lub pierwsza energia jonizacji, co odpowiada usunięciu pierwszego elektronu. Jest to zwykle najniższa energia jonizacji, ponieważ elektron ten znajduje się najdalej od jądra, jego siła przyciągania do rdzenia jest najniższa, wymaga mniej energii i jest łatwiejsza usunąć to.
Co więcej, wraz z utratą elektronów promień atomowy maleje, a jon staje się coraz bardziej dodatni, stąd przyciąganie z jądro staje się silniejsze, a w konsekwencji potrzeba więcej energii, aby wyciągnąć następny elektron i tak sukcesywnie.
Rozważmy przykład, atom sodu ma jako pierwszą energię jonizacji wartość 406 kJ/mol. Jego druga energia jonizacji wynosi 4560, czyli znacznie wyższa niż pierwsza. To pokazuje, że sód potrzebuje dużo więcej energii, aby wyciągnąć dwa elektrony niż tylko jeden. Dlatego w naturze częściej spotyka się atomy sodu o ładunku +1.
Zwróć uwagę, jak to się dzieje w przypadku aluminium poniżej:
13Al+ 577,4 kJ/mol → 13Glin1++ i-
13Al+ 1816,6 kJ/mol → 13Glin2++ i-
13Al+ 2744,6 kJ/mol → 13Glin3++ i-
13Al+ 11575,0 kJ/mol → 13Glin4++ i-
Tak więc dla aluminium mamy następujący porządek energii jonizacji (EI):
Teraz nie przestawaj... Po reklamie jest więcej ;)
I ZI < II ZI < III ZI <<< IV ZI
Z tego faktu możemy wywnioskować, że:

Dlatego jeśli weźmiemy pod uwagę pierwiastki z tej samej rodziny lub w tym samym okresie układu okresowego, zobaczymy, że wraz ze wzrostem liczby atomowej tym niższe energie jonizacji, ponieważ im dalej od jądra elektrony oni są. W ten sposób energia jonizacji rośnie w układzie okresowym od dołu do góry i od lewej do prawej. Dlatego energia jonizacji jest właściwością okresową.
Zobacz jak to pokazano poniżej i porównaj wartości pierwszej energii jonizacji niektórych atomów, które uzyskano eksperymentalnie w kJ (kilodżule):

Zwróć uwagę, że wartości energii jonizacji pierwiastków z drugiego okresu układu okresowego są większe niż te z trzeciego okresu i tak dalej. Zwróć też uwagę na fakt, że pierwsze energie jonizacji pierwiastków z rodziny 1A są niższe niż w przypadku 2A i tak dalej.
Te reprezentatywne pierwiastki, które mają niską energię jonizacji, tracą elektrony, aby stać się stabilnymi, to znaczy mieć konfigurację gazu szlachetnego. Te o wysokiej energii jonizacji (ametale) otrzymują elektrony zamiast je tracić.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. "Energia jonizacji"; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/energia-ionizacao.htm. Dostęp 28 czerwca 2021 r.