Związki organiczne można przedstawić na wiele sposobów, takich jak płaski wzór strukturalny, uproszczony lub skondensowany wzór strukturalny lub wzór z myślnikiem. Jednak najprostszą reprezentacją jest wzór cząsteczkowy.

Zobaczmy zatem, jak wyznaczyć wzór cząsteczkowy związków organicznych na podstawie innych wymienionych wyżej wzorów.
1. Poprzez Płaski Wzór Strukturalny:ten wzór pokazuje rozmieszczenie lub rozmieszczenie atomów w cząsteczce. Na przykład poniżej znajduje się płaski wzór strukturalny jednego z węglowodorów obecnych w benzynie.

Zauważ, że w tym wzorze pokazane są wszystkie atomy i wszystkie istniejące wiązania między nimi. Teraz, aby określić wzór cząsteczkowy tego związku, wystarczy policzyć liczbę atomów każdego pierwiastka i umieścić indeks w prawym dolnym rogu danego pierwiastka.
Ważnym aspektem, który należy podkreślić, jest to, że wzór cząsteczkowy związków organicznych zawsze zaczynamy od pierwiastka węgiel, ponieważ jest głównym składnikiem tych substancji. Zobacz przykład:
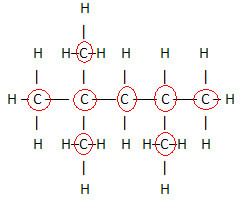
Ponieważ węgli jest 8, zaczynamy pisać wzór cząsteczkowy w ten sposób: DO8
Aby uzupełnić ten wzór, liczymy ilość wodorów:
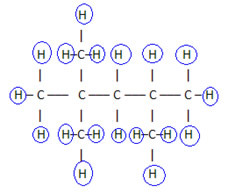
Więc twój formuła molekularna é DO8H18.
2. Poprzez uproszczony lub skondensowany wzór strukturalny: w tego typu formule ilość wodorów jest skrócona. Na przykład spójrz na tę samą formułę cząsteczki znalezionej w benzynie, teraz w postaci skondensowanej:
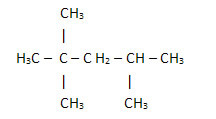
Teraz nie przestawaj... Po reklamie jest więcej ;)
W ten sposób jeszcze łatwiej policzyć ilość wodorów, wystarczy dodać wskaźniki (3 +3+ 3 +2 +1 +3 +3 = 18).
Ale teraz spójrzmy na skondensowany wzór strukturalny kwasu linolowego, który występuje w warzywach takich jak bawełna, soja, słonecznik itp. i który jest używany w farbach i lakierach:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Licząc ilość węgli, wodorów i tlenów, mamy następujące formuła molekularna kwasu linolowego: DO18H32O2.
3. Poprzez formułę udaru: ten wzór dodatkowo upraszcza sposób przedstawiania związków organicznych, ponieważ pomija grupy C, CH, CH2 i CH3.
Przykładem jest cząsteczka linolowa, zobacz jak wygląda:

Najpierw policzmy ilość węgli, pamiętając, że w tym wzorze każde wiązanie między węglem jest reprezentowane przez myślnik. Tak więc końcówki, podobnie jak dwa punkty przegięcia, odpowiadają atomom węgla.
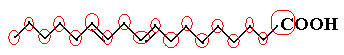
Więc mamy: DO18
Teraz, aby policzyć ilość wodorów, musimy pamiętać, że wiązania między węglem a wodorami są implikowane, ponieważ wiadomo, że węgiel tworzy cztery wiązania; tak więc ilość wiązań, których brakuje, jest ilością wodoru związanego z tym pierwiastkiem.
Zobacz wyjaśnienia poniżej:
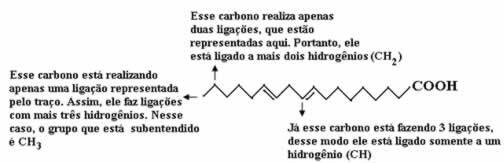
Zatem ilość wodorów wyniesie: 32.

Ilość tlenu jest dość prosta do obliczenia, ponieważ są tylko dwa. Ponieważ formuła molekularna é: DO18H32O2.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Wzory molekularne związków organicznych”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm. Dostęp 28 czerwca 2021 r.
Wzór przestrzenny węgla, wzór elektroniczny Lewisa, struktura płaska, pary elektronowe, wiązanie kowalencyjna, warstwa walencyjna, ewolucja modelu atomowego, wzór cząsteczkowy, wzór strukturalny, wzory trójwymiarowy.
Wzory chemiczne, płaski wzór strukturalny, wzór strukturalny Coupera, wiązanie potrójne, gaz azot, wzór elektroniczny, wzór Lewisa, wzór cząsteczkowy, wiązanie pojedyncze, wiązanie podwójne, gaz węglowy.