TEN entalpia formacji, nazywany również standardowa entalpia tworzenia,, lub standardowe ciepło formowania, to obliczenie ciepła uwolnionego lub pochłoniętego podczas tworzenia 1 mola substancji z prostych substancji w stanie standardowym.
Nie jest możliwe obliczenie wartości bezwzględnych entalpii każdej substancji, ale możliwe jest obliczenie zmiany entalpii występującej w reakcji za pomocą kalorymetru.
Trzeba o tym pamiętać uzgodniono przyjęcie wartości entalpii równej zero dla prostych substancji w stanie standardowym. Tak więc, jeśli chcemy dowiedzieć się, jaka jest entalpia tworzenia substancji, wystarczy znać wartość entalpii jej reakcji tworzenia z prostych substancji.
Na przykład chcemy obliczyć entalpię 18 gramów wody, co odpowiada 1 molowi, ponieważ jej masa molowa wynosi 18 g/mol. Aby to zrobić, najpierw potrzebujemy reakcji, aby utworzyć wodę z prostych substancji, jak pokazano poniżej:
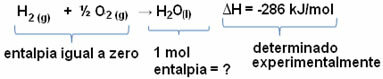
Należy zauważyć, że wartość zmiany entalpii, która wystąpiła w tej reakcji została wyznaczona eksperymentalnie za pomocą kalorymetru i wynosi -286 kJ/mol.
Wzór, który oblicza tę zmianę entalpii (ΔH) to:
ΔH = HProdukty - HOdczynniki
Skoro więc znamy już wartość ΔH i że entalpia reagentów jest równa zeru (ponieważ są to proste substancje w stanie standardowym), możemy wnioskować że wartość entalpii 1 mola wody jest równa zmianie entalpii reakcji tworzenia, ponieważ jest to jedyny produkt tej reakcji, jak pokazano poniżej:
ΔH = HProdukty - HOdczynniki
-286 kJ/mol = HH2O - (HH2 + H1/2 O2)
-286 kJ/mol = HH2O - 0
HH2O = - 286 kJ/mol
Ten rodzaj entalpii, uzyskiwany z entalpii prostych substancji w stanie standardowym, jest zatem standardowa entalpia tworzenia (ΔH0).
Obecnie istnieje wiele substancji, które nie powstają bezpośrednio w pojedynczej reakcji, np. woda. W takich przypadkach entalpię tworzenia można obliczyć na podstawie zmiany entalpii reakcji.
Na przykład NH4Cl powstaje w wyniku następującej reakcji:
NH3 + HCl → NH4Cl ΔH = -176 kJ/mol
Zauważ, że żaden z reagentów nie jest prostą substancją, więc nie możemy przypisać im entalpii równej zero. Musimy znać entalpie tworzenia każdego z odczynników, ponieważ powstają one w wyniku reakcji między prostymi substancjami:
NH3: ΔH = -46 kJ/mol
HCl: ΔH = -92,4 kJ/mol
Dodając te dwie entalpie, otrzymujemy wartość entalpii reagentów i możemy znaleźć entalpię NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Zastąpienie w formule:
ΔH = HProdukty - HOdczynniki
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
W tym przypadku bezpośrednio zsumowaliśmy wartości entalpii tworzenia reagentów, ponieważ stosunek reakcji wynosił tylko 1 mol. Jeśli jednak w innych reakcjach ilość moli jest inna, konieczne będzie najpierw pomnożenie entalpii tworzenia reagenta przez liczbę moli.
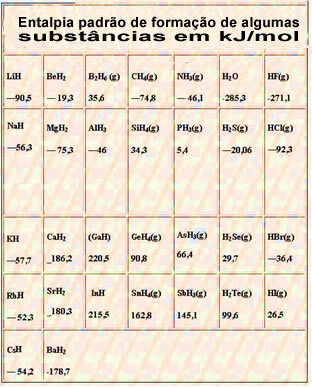
Poniżej znajduje się tabela ze standardową entalpią tworzenia niektórych substancji w 25 °C i 1 atm:
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm