Joseph Lous Gay-Lussac (1778-1850) był naukowcem, który przeprowadził ważne badania gazów. Przeprowadził produkcję wody z reakcji między gazami wodoru i tlenu i potwierdził, że zawsze reagował w stosunku dwóch objętości wodoru do jednej objętości tlenu, wytwarzając dwie objętości Woda:
Wodór + Tlen → Woda
1. Eksperyment: 2 l 1 l 2 l
Drugi eksperyment: 4 l 2 l 4 l
Trzeci eksperyment: 8 l 4 l 8 l
4. Eksperyment: 16 l 8 l 160 l
Zauważ, że we wszystkich eksperymentach stosunek jest zawsze taki sam: 2: 1: 2.
Po kilku eksperymentach i analizach zdałem sobie sprawę, że to samo zachodzi z innymi rodzajami reakcji między gazami, czyli reakcjami zawsze podążał za stałym stosunkiem objętości, naukowiec ten doszedł do następującego prawa reakcji w objętościach gazowych, znanego jako Prawo wolumetryczne Gay-Lussaca lub Prawo kombinacji tomów:

Stwierdzenie prawa objętościowego Gay-Lussaca
Ale to prawo było sprzeczne z Teoria atomowa Daltona, który mówi, że wszystko składa się z masywnych i niepodzielnych kulistych cząstek, atomów. Zgodnie z tą teorią objętość produktów w reakcji powinna być równa sumie objętości reagentów. W związku z tym powinny wystąpić:
Wodór + Tlen → Woda
2 tomy + 1 tom → 3 tomy
Ale Gay-Lussac wykazał, że w praktyce tak nie było, wynik był równy dwóm objętościom pary wodnej.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Odpowiedź na tę pozorną sprzeczność pojawiła się w następujący sposób: hipoteza lub Prawo Avogadro.

Pieczęć wydrukowana we Włoszech przedstawia Amedeo Avogadro i wypowiedzenie jego prawa w 1956 r.*
Amedeo Avogadro (1776-1856) wykazali, że w rzeczywistości gazy nie były izolowanymi atomami, lecz cząsteczkami (z wyjątkiem Gazy szlachetne). Jego prawo mówiło:

Oświadczenie o prawie Avogadro
Avogadro to pokazał 1 kret dowolnego gazu ma 6.02. 1023 molekuły. Ta wartość jest znana jako Liczba lub stała Avogadro. Wykazano, że w normalnych warunkach temperatury i ciśnienia (CNTP), w których ciśnienie wynosi 1 atm, a temperatura 273 K (0°C), objętość zajmowana przez 1 mol dowolnego gazu będzie zawsze wynosić 22,4 l. Ta wartość odpowiada molowa objętość gazów. Te relacje są bardzo ważne przy rozwiązywaniu ćwiczeń stechiometria.
Może się to wydawać dziwne, ponieważ może pojawić się następujące pytanie: Jak gazy z cząsteczkami i atomami o różnych rozmiarach mogą zajmować tę samą objętość?
Cóż, dzieje się tak dlatego, że cząsteczki gazu są tak daleko od siebie, że rozmiar cząsteczek jest znikomy.
W ten sposób prawo objętościowe Avogadro wyjaśniało prawo objętościowe Gay-Lussaca. Zauważ poniżej, że dwie cząsteczki wodoru (dwie objętości) reagują z jedną cząsteczką tlenu (jedna objętość), tworząc dwie cząsteczki wody (dwie objętości). Woda i wodór mają tę samą objętość, ponieważ mają taką samą ilość cząsteczek, jak mówi prawo Avogadro.
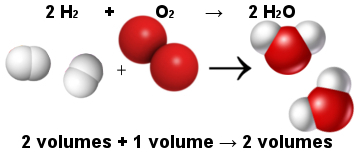
Proporcja między cząsteczkami w reakcji tworzenia wody
W tym samym czasie prawo Avogadro utwierdziło teorię atomową w mocy, ponieważ widać, że zarówno w substratach, jak i produktach jest w sumie 6 atomów (4 wodór i 2 tlen).
Te prawa wolumetryczne były bardzo ważne dla rozwoju koncepcji molekuły.
* Obraz chroniony prawem autorskim: wieża76 / Shutterstock.com
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Prawo wolumetryczne Gay-Lussaca”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm. Dostęp 28 czerwca 2021 r.
Czym są gazy, jakie są właściwości gazów, związków cząsteczkowych, ściśliwości, stałej objętości, energii kinetycznej średnia, temperatura bezwzględna gazu, gaz doskonały, gazy rzeczywiste, gaz doskonały, zmienne stanu gazu, objętość gazu, pory roku
Chemia

prawa Gay-Lussaca, prawo Prousta, reakcja chemiczna, stała proporcja, masy substancji, czysta substancja, analiza jakościowe i ilościowe, prawo gazów doskonałych, prawo stałych proporcji, prawo określonych proporcji, prawo wolumetryczny.
