Jak pokazano w tekstach "Widmo elektromagnetyczne pierwiastków chemicznych" i "Widma emisyjne i absorpcyjne oraz prawa Kirchhoffa”, nieciągłe widma emisyjne każdego pierwiastka chemicznego są różne.

Poniżej mamy więc wyraźne widma niektórych z tych pierwiastków:

Tak więc duński fizyk Niels Böhr (1885-1962) zdał sobie sprawę, że może to być związane ze strukturą atomu każdego z tych pierwiastków. Zaproponował więc model atomowy, który uzupełniał model Rutherforda, ale skupił się na zachowaniu otaczających elektronów w jądrze atomu.
Jakiś czas wcześniej Max Planck (1858-1947) zaproponował teorię, że elektrony są skwantyzowanyw tym sensie, że emitują i pochłaniają określone ilości energii, jakby były małymi pakietami energii, który nazwał ile (kwant, w liczbie pojedynczej).
W związku z tym Böhr zaproponował, co następuje: ponieważ każdy pierwiastek ma inne widmo, każdy pierwiastek ma w swoim atomie elektrony o stałej i różnej energii od pierwiastka do pierwiastka.
Każdy elektron może przebywać tylko na określonej orbicie, ponieważ w każdej z tych orbit elektron ma stałą, dobrze określoną i charakterystyczną energię. Elektron może zajmować tylko te poziomy energii, dla których ma odpowiednią energię.
Widma są nieciągłe, ponieważ elektrony są skwantowane.
Elektron może zmieniać poziomy tylko wtedy, gdy pochłania energię. Na przykład, kiedy spalasz sól sodową w palniku Bunsena, dostarczasz energię elektronom. Pochłaniając kwant energii, elektron przeskakuje na kolejny, bardziej energetyczny poziom, pozostając w stanie wzbudzonym. Jednak stan podstawowy jest bardziej stabilny, więc elektron ten emituje pochłoniętą energię i powraca na swoją pierwotną orbitę. Emituje tę energię w postaci fal elektromagnetycznych, które można wizualizować w postaci światła. W przypadku sodu światło to ma intensywnie żółty kolor. Tak więc, gdy te fale przechodzą przez pryzmat, otrzymuje się nieciągłe widmo sodu.
Tak więc dla Böhra każda linia świetlna, która pojawiła się w nieciągłym widmie pierwiastków, wskazywała energię uwolnioną, gdy elektron powrócił z poziomu zewnętrznego do poziomu bliższego jądru.
Poniższy rysunek pomaga lepiej zrozumieć ten problem:
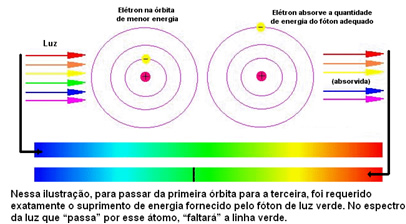
Ponieważ atomy każdego pierwiastka mogą mieć tylko określone wartości energetyczne, które odpowiadają warstwom energetycznym, dla każdego pierwiastka istnieje inne widmo.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm

