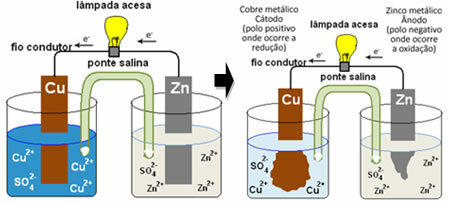
O obliczanie potencjału a bateria jest wykonywany, gdy chcesz wiedzieć z wyprzedzeniem (przed montażem) jakie będzie napięcie, emf (siła elektromotoryczna) lub ddp (różnica potencjałów), którą dana komórka wygeneruje z dwóch metali o różnych właściwościach.
Termin został użyty z góry, ponieważ jeśli chcemy zmierzyć napięcie dowolnego urządzenia, czy to ogniwa, czy baterii, wystarczy użyć multimetru.
Każdy z metali biorących udział w składzie anody i katody ogniwa ma inny zdolność do ulegania utlenianiu (zdolność do utraty elektronów) i redukcji (zdolność do zdobywania) elektrony). Ta zdolność do utleniania lub redukcji nazywana jest potencjałem. Dlatego metale tworzące elektrodę ogniwa mogą mieć:
Standardowy potencjał redukcyjny (Eczerwony): jest zdolnością elektrody do poddawania się zjawisku redukcji. Potencjał ten jest mierzony w woltach (V), a jego wartość jest taka sama jak standardowego potencjału utleniania, ale z przeciwnym znakiem.
Standardowy potencjał utleniania (Etlen): jest to pojemność, z jaką elektroda musi cierpieć zjawisko utleniania. Potencjał ten jest mierzony w woltach (V) i jego wartość jest taka sama jak standardowy potencjał redukcyjny, ale z przeciwnym znakiem.
UWAGA: Na standardowy potencjał może mieć wpływ temperatura i stężenie roztworów użytych do montażu pala.
Występować obliczanie potencjału baterii, musimy znać wartości standardowych potencjałów, czy to utleniania, czy redukcji, i stosować w poniższych Równanie matematyczne:
ΔE = Eczerwony (większy) - Andczerwony (mniejszy)
lub
ΔE = Etlen (większy) - Andtlen (mniejszy)
ΔE = zmiana potencjału baterii (emf lub ddp).
Równanie to wykorzystuje zmienność potencjału, ponieważ podobnie jak w urządzeniu, zachodzi utlenianie i redukcja, miara potencjału zostanie podana po prostu przez odjęcie potencjału każdej z elektrod (metale).
UWAGA: Możemy tylko powiedzieć, że pracujemy ze stosem, gdy doobliczenie potencjalnych wyników w wartości dodatniej.
Teraz podążaj za niektórymi przykłady pytań, które dotyczą doobliczanie potencjału baterii:
Przykład 1: (UFSC-SP) Biorąc pod uwagę półreakcje:
2 Fe+2 → 2 Fe+3 + 2 i Etlen = - 0,77 V
2 kl-1 → 1 Cl2 + 2 i Etlen = - 1,36V
Oblicz potencjał reakcji poniżej (stack) i powiedz, czy jest spontaniczna, czy nie, zaznaczając poprawną opcję:
Teraz nie przestawaj... Po reklamie jest więcej ;)
2 Fe+2 + Cl2 → 2 Fe+3 + 2 kl-1
a) – 0,59V, nie jest spontaniczne
b) 0,59 V, nie jest spontaniczne
c) 0,59 V, jest spontaniczne
d) – 2,13 V, nie jest spontaniczne
e) 2,13 V, jest spontaniczne
Rozkład:
Ponieważ ćwiczenie poprosi Cię o określenie wartości potencjału baterii, po prostu przeanalizuj podane potencjały utleniania, aby ocenić, który jest najwyższy, a który najniższy:
2 Fe+2 → 2 Fe+3 + 2 i Etlen = - 0,77 V (To jest największy)
2 kl-1 → 1 Cl2 + 2 i Etlen = - 1,36V (to jest najmniejszy)
Następnie zastosuj go we wzorze na obliczenie potencjału baterii:
ΔE = Etlen (większy) - Andtlen (mniejszy)
ΔE = - 0,77 - (-1,36)
ΔE = - 0,77 + 1,36
ΔE = + 0,59 V
Ponieważ znaleziony potencjał ma wartość pozytywną, mamy do czynienia z procesem spontanicznym. List do).
Przykład 2: (UFMS) Rozważmy półreakcje, wskazane poniżej, z ich odpowiednimi standardowymi potencjałami redukcyjnymi, w woltach (V):
Ag+ + i → Ag Eczerwony = 0,80V
Tyłek+2 + 2 i → Cu Eczerwony = 0,34V
Oblicz potencjał reakcji poniżej (stack) i powiedz, czy jest spontaniczna, czy nie, zaznaczając poprawną opcję:
Cu + 2 Ag+→ Cu+2 + 2 Ag
a) – 4,6 V
b) - 0,46 V
c) + 0,46 V
d) + 1,14V
e) - 1,14 V
Rozkład:
Ponieważ ćwiczenie prosi o wyznaczenie wartości potencjału stosu, wystarczy przeanalizować podane potencjały redukcyjne, aby ocenić, który jest największy, a który najmniejszy:
Ag+ + i → Ag Eczerwony = 0,80V (To jest największy)
Tyłek+2 + 2 i → Cu Eczerwony = 0,34V (to jest najmniejszy)
Następnie zastosuj go we wzorze na obliczenie potencjału baterii:
ΔE = Eczerwony (większy) - Andczerwony (mniejszy)
ΔE = 0,80 - (0,34)
ΔE = 0,80 - 0,34
ΔE = + 0,46 V
Ponieważ znaleziony potencjał ma wartość pozytywną, mamy do czynienia z procesem spontanicznym. List do).
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Obliczanie potencjału komórki”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/calculo-potencial-uma-pilha.htm. Dostęp 28 czerwca 2021 r.