Każda komórka jest urządzeniem, w którym zachodzi spontaniczna reakcja oksydacyjno-redukcyjna, która generuje prąd elektryczny, który z kolei jest wykorzystywany do działania niektórych urządzeń.
Te urządzenia otrzymały swoją nazwę, ponieważ pierwsza bateria, która została stworzona, została wynaleziona przez Alessandro W 1800 roku został utworzony przez cynkowe i miedziane krążki oddzielone nasączoną bawełną solanka. Ten zestaw został umieszczony naprzemiennie, jeden na drugim, nagromadzenie dyski i tworząc dużą kolumnę. Jak było? bateria dysków, zaczęto nazywać tą nazwą.

Baterie zawsze składają się z dwóch elektrod i elektrolitu. Elektroda dodatnia nazywa się a katoda i tutaj reakcja zmniejszenie. Elektroda ujemna to anoda i tutaj reakcja utlenianie. Nazywany jest również elektrolit Most solny i jest rozwiązaniem przewodzącym jony.
Aby zrozumieć, w jaki sposób generuje on prąd elektryczny, zobacz przypadek jednej z pierwszych baterii, stos Daniella, w którym znajdował się pojemnik z roztworem siarczanu miedzi (CuSO
4(aq)) i zanurzona w tym roztworze była miedzianą płytką. W innym oddzielnym pojemniku znajdował się roztwór siarczanu cynku (ZnSO4(aq)) i cynkowaną metodą zanurzeniową. Oba roztwory połączono mostkiem solnym, którym była szklana rurka z roztworem siarczanu potasu (K2TYLKO4(aq)) z wełną szklaną na końcach. Ostatecznie obie płytki zostały połączone zewnętrznym obwodem z lampą, której świecenie wskazywałoby na przepływ prądu elektrycznego: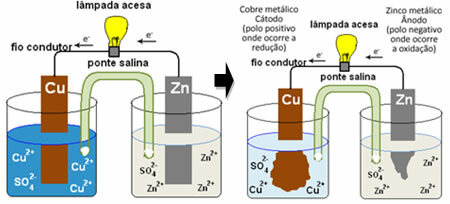
Dzieje się tak, że cynk ma większą tendencję do utleniania się, to znaczy do utraty elektronów, więc metaliczny cynk ostrza działa jak elektroda ujemna, anoda, w której zachodzi utlenianie: Zn(s) Zn2+(tutaj) + 2 i-. Elektrony utracone przez cynk są transportowane przez obwód zewnętrzny do miedzi, generując prąd elektryczny, który włącza lampę. Jony miedzi w roztworze odbierają elektrony (redukują) i przekształcają się w metaliczną miedź osadzaną na blasze miedzianej. Oznacza to, że jest to elektroda dodatnia, katoda, gdzie następuje redukcja: Tyłek2+(tutaj) + 2 i- dupa(s).
Teraz nie przestawaj... Po reklamie jest więcej ;)
Dzisiejsze baterie mają tę samą zasadę działania, w której jeden metal przekazuje elektrony drugiemu poprzez roztwór przewodzący i wytwarzany jest prąd elektryczny. Różnica polega na tym, że używane obecnie baterie są suche, ponieważ nie używają płynnego roztworu jako elektrolitu, jak ma to miejsce w baterii Daniella.
Obecnie istnieje bardzo szeroka gama akumulatorów sprzedawanych na rynku. Wśród nich najczęstsze są komórki kwasowe (z Leclanché) ibaterie alkaliczne.
Oba mają cynk jako elektrodę ujemną; z drugiej strony jako biegun dodatni w środku stosu zainstalowany jest pręt grafitowy otoczony dwutlenkiem manganu (MnO2), sproszkowany węgiel drzewny (C) i mokrą pastę. Różnica polega na tym, że w stosie kwasu w mokrej paście stosuje się chlorek amonu (NH).4Cl) i chlorek cynku (ZnCl2) - sole kwaśne - oprócz wody (H2O). W baterii alkalicznej stosowany jest wodorotlenek potasu (KOH), który jest zasadą.

Baterie Leclanché najlepiej nadają się do sprzętu wymagającego lekkiego i ciągłego rozładowania, takiego jak pilot, zegar ścienny, przenośne radio i zabawki. Z drugiej strony baterie alkaliczne mają od 50 do 100% więcej energii niż zwykła bateria o tym samym rozmiarze, zalecana do sprzętu, który wymagają szybszego i bardziej intensywnego pobierania, np. z radia, odtwarzaczy CD/DVD, przenośnych plików MP3, latarek, cyfrowych aparatów fotograficznych itp.

Dowiedz się więcej o tym, jakie elektrolity i elektrody są używane w tych i innych typach baterii. co do tego, jakie rodzaje sprzętu są najbardziej polecane, przeczytaj powiązane artykuły więcej poniżej.
Jennifer Fogaça
Absolwent chemii
