Bateria jest to system, w którym energia chemiczna jest spontanicznie przekształcana w energię elektryczną.
W 1836 r. angielski chemik i meteorolog John Frederic Daniell (1790-1845) zbudował stos inny od znanego wówczas: stos Alessandro Volty. W tym stosie on połączone ze sobą dwie elektrody, które były układami składającymi się z metalu zanurzonego w wodnym roztworze soli utworzonej przez kationy tego metalu.
Jedna z elektrod, elektroda miedziana, składała się z miedzianej płytki zanurzonej w roztworze siarczanu miedzi (CuSO4). Drugą elektrodą była elektroda cynkowa składająca się z płytki cynkowej zanurzonej w roztworze siarczanu cynku (ZnSO4).
Te dwie elektrody były połączone ze sobą obwodem elektrycznym, który zawierał lampę, ponieważ gdyby się włączyła, wskazywałoby to na pojawienie się prądu elektrycznego.
Między nimi był też solny most. Ten mostek składał się ze szklanej rurki w kształcie litery U zawierającej stężony wodny roztwór wysoce rozpuszczalnej soli, takiej jak na przykład chlorek potasu (KCl (aq)). Końce probówki pokryte są bawełną lub agarem.
Poniżej mamy strukturę tego ogniwa lub ogniwa elektrochemicznego, które stało się znane jako ogniwo Daniella. Pamiętając, że każda elektroda nazywana jest półogniwem.
Przy zamkniętym obwodzie lampka włącza się i po pewnym czasie, blacha cynkowa jest skorodowana i ma zmniejszoną masę, natomiast blacha miedziana jest odwrotnie, jej masa wzrasta (jak pokazano na rysunku poniżej). Należy również zauważyć, że następuje wzrost stężenia jonów Zn w mol/L2+ oraz spadek jonów Cu2+.
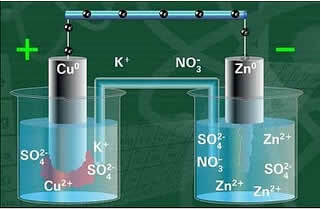
Schemat stosu Daniella.
Dlaczego to się dzieje?
Teraz nie przestawaj... Po reklamie jest więcej ;)
Aby zrozumieć, spójrzmy na reakcje, które zachodzą na każdej elektrodzie osobno.
W elektrodzie cynkowej zachodzi następująca reakcja równowagowa:
Zn(y) ↔ Zn2+(tutaj) + 2 i-
Oznacza to, że metaliczny cynk (z płyty) ulega utlenianiu, to znaczy oddaje dwa elektrony do kationu cynku (z roztworu) i staje się Zn2+. Występuje również sytuacja odwrotna, kation cynku obecny w roztworze otrzymuje dwa elektrony oddane przez cynk i staje się metalicznym cynkiem. Dlatego zachodzi nieprzerwany proces utleniania i redukcji.
To samo dotyczy elektrody miedzianej, która w równowadze dynamicznej będzie miała reakcję globalną: Cu(s) ) Cu2+(tutaj) + 2 i-
Daniell zdał sobie sprawę, że jeśli połączy te dwie elektrody, bardziej reaktywna odda swoje elektrony mniej reaktywnemu kationowi, zamiast robić to z kationami w swoim własnym roztworze. W tym przypadku cynk jest najbardziej reaktywny i ulega utlenianiu, oddając elektrony miedzi, stąd spadek jego masy. Utlenianą elektrodą jest biegun ujemny, zwany anodą. Elektroda miedziana jest tą, która ulega redukcji, kation miedzi otrzymuje dwa elektrony z cynku i jest nazywana katodą (biegun dodatni).
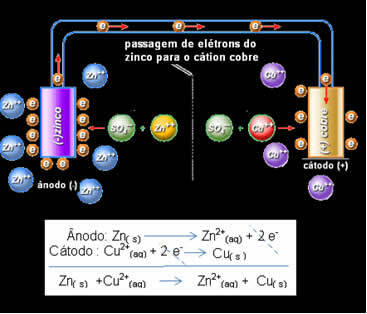
Przejście elektronu i globalne równanie stosu Daniella.
Powyżej mamy globalne równanie dla tego stosu, które otrzymujemy przez dodanie dwóch reakcji połówkowych. Jego reprezentację lub notację chemiczną sporządzono według następującej zasady:

Tak więc dla stosu Daniella mamy:
Zn / Zn2+// tyłek2+ / dupa
Jennifer Fogaça
Absolwent chemii
Brazylijska drużyna szkolna
Fizykochemiczne - Chemia - Brazylia Szkoła
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Stos Danilla”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Dostęp 28 czerwca 2021 r.

