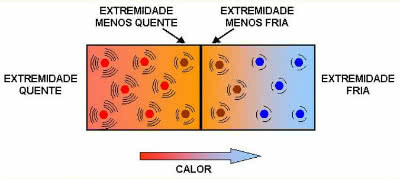
Dynamisk likevekt eller kjemisk likevekt i en reaksjon oppstår når reaksjonene forover og bakover forekommer samtidig. Disse såkalte reversible systemene er representert av piler i begge retninger:  eller
eller  . Et eksempel på en reversibel reaksjon er sitert i bildet ovenfor, mellom jodgass og hydrogengass.
. Et eksempel på en reversibel reaksjon er sitert i bildet ovenfor, mellom jodgass og hydrogengass.
I begynnelsen av reaksjonen er mengden reaktanter maksimalt, og mengden av produkter er null. Reaktantene reagerer imidlertid med hverandre, reduserer konsentrasjonen og øker de av de dannede produktene. Utviklingshastigheten for den direkte reaksjonen avtar også.
Når konsentrasjonen av produktene øker, starter den omvendte reaksjonen og reaktantene dannes igjen; utviklingshastigheten til den omvendte reaksjonen øker også.
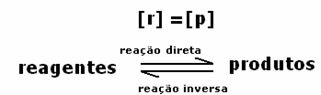
Når kjemisk likevekt er oppnådd, ved konstant temperatur, er utviklingshastighetene for fremover og omvendte reaksjoner like.
Alledirekte = Alle omvendt
Priser er de samme, men konsentrasjoner er ikke. Konsentrasjonen av reagenser og produkter er neppe den samme. Bare i sjeldne tilfeller skjer dette. I de fleste tilfeller vil reagenskonsentrasjonen være høyere enn for produkter eller omvendt.
Dermed har vi tre mulige måter å grafisk representere utviklingshastighetene på direkte og omvendte reaksjoner, som relaterer konsentrasjonene av reaktanter og produkter over tid. La oss se på hvert tilfelle:
1. sak: Like konsentrasjoner:
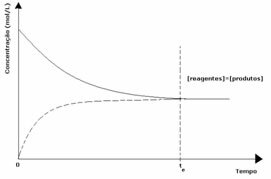
Som vist i grafen, på tidspunktet tog reaksjonene forover og bakover er de samme, i hvilket tilfelle konsentrasjonene av reaktanter og produkter er de samme. Dermed forskyves ikke balansen til begge sider, intensiteten til begge reaksjonene er den samme, som uttrykt nedenfor:
Ikke stopp nå... Det er mer etter annonseringen;)
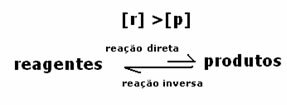
2. sak: Konsentrasjon av reagenser som er større enn konsentrasjonen av produkter:
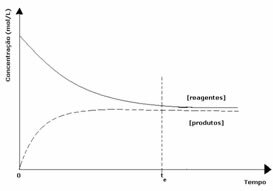
I dette tilfellet observeres det at når man når likevekt, er konsentrasjonen av reaktanter større enn produktene. Dermed konkluderes det at hvis det er mer reaktant, skjer den omvendte reaksjonen med større intensitet. Reaksjonen forskyves til venstre:
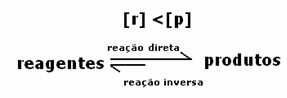
3. sak: Konsentrasjon av produkter som er større enn reagenser:
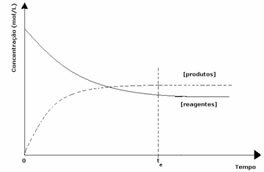
Siden konsentrasjonen av produkter i likevekt er større, betyr dette at reaksjonen er forskjøvet til høyre, fordi den direkte reaksjonen (med dannelse av produkter) skjer med større intensitet.
Det som vil indikere om reaksjonen har en tendens til høyre eller venstre, vil være likevektskonstanten K, som bare avhenger av temperaturen.
Av Jennifer Fogaça
Uteksamen i kjemi
Brasil skolelag
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Grafisk studie av kjemisk balanse"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Tilgang 28. juni 2021.
Kjemi

Test din kunnskap og lær mer med denne listen over løste øvelser om kjemiske balanser. Gjennom dette materialet vil du være i stand til å bedre forstå hvordan man arbeider likevektskonstanter (Kp, Kc og Ki), likevektsskift, pH og pOH, samt likevekt i såkalte bufferløsninger.