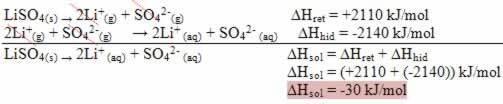
Oppløsningsmiddel og løsemiddel er de to komponentene i en homogen blanding som kalles en kjemisk løsning.
- Oppløselig: er stoffet som er dispergert i løsningsmidlet. Det tilsvarer stoffet som vil bli oppløst og presenterer seg generelt i en mindre mengde i løsningen.
- Løsemiddel: er stoffet der det oppløste stoffet vil oppløses for å danne et nytt produkt. Den presenterer seg i større mengde i løsningen.
Oppløsning mellom det oppløste stoffet (dispergert) og løsningsmidlet (dispergeringsmidlet) skjer gjennom interaksjoner mellom molekylene deres.
Forskjellen mellom disse to komponentene i en løsning er at løsemidlet er stoffet som vil oppløses, og løsningsmidlet er stoffet som vil påvirke oppløsning.
Det mest kjente løsningsmidlet er vann, regnet som universal løsemiddel. Det er fordi den har evnen til å oppløse en stor mengde stoffer.
Løsemiddel- og løsemiddeleksempler
Se noen eksempler på kjemiske løsninger og oppdag løsningsmidlene og løsningsmidlene til hver av dem:
Vann og salt
- Oppløsningsmiddel: Bordsalt - Natriumklorid (NaCl)
- Løsemiddel: Vann
Siden det er en ionisk forbindelse, dissosierer natriumkloridet i løsningen og danner ioner som igjen blir solvert av molekyler av Vann.
Den positive vannpolen (H+samhandler med saltanionen (Cl-) og den negative vannpolen (O2-) samhandler med kationen (Na+).
Dette er en type elektrolytisk løsning, da de ioniske artene i løsningen er i stand til å lede en elektrisk strøm.
vann og sukker
- Oppløsningsmiddel: Sukker - sukrose (C12H22O11)
- Løsemiddel: Vann

Sukker er en kovalent forbindelse og når den er oppløst i vann molekyler de sprer seg, men endrer ikke identiteten.
Denne vandige løsningen er klassifisert som ikke-elektrolytisk, da løsningen dispergert i løsningen er nøytral og reagerer derfor ikke med vann.
Eddik
- Oppløselig: Eddiksyre (CH3COOH)
- Løsemiddel: Vann

Eddik er en løsning som inneholder minst 4% eddiksyre, a karboksylsyre som er polar, samhandler med vann, også polar, gjennom hydrogenbindinger.
En viktig regel for løselighet er at som oppløses som. Polare forbindelser er oppløst i polare løsemidler, mens ikke-polære stoffer oppløses i ikke-polære løsemidler.
Andre løsninger
I tillegg til flytende løsninger er det også gassformige og faste løsninger.
Luften vi puster inn er et eksempel på en gassformet løsning, hvis gasser i større mengde er nitrogen (78%) og oksygen (21%).
På metalllegeringer de er solide løsninger. For eksempel er messing (sink og kobber) en blanding som brukes til å lage musikkinstrumenter.
Vil du få mer kunnskap? Så les disse andre tekstene:
- Kjemiske løsninger
- intermolekylære krefter
- Homogene og heterogene blandinger
Hva er løselighetskoeffisienten?
Løselighetskoeffisienten er grensen for oppløst stoff tilsatt løsningsmidlet ved en gitt temperatur for å danne en mettet løsning.
O løselighetskoeffisient varierer i henhold til forholdene, og kan øke eller redusere i henhold til temperaturendringer og det oppløste stoffet.
Det er en grense som løsningsmidlet kan utføre oppløsning.
Eksempel: Hvis du legger sukker i et glass vann, i første øyeblikk, vil du merke at sukkeret forsvinner i vannet.
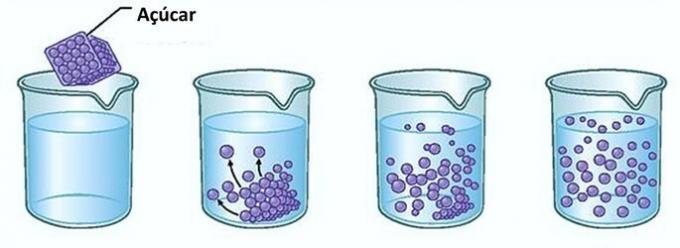
Men hvis du fortsetter å tilsette sukker, vil du oppdage at det på et tidspunkt begynner å akkumuleres i bunnen av glasset.
Dette er fordi vannet, som er løsningsmidlet, har nådd grensen på løselighet og maksimal konsentrasjonsmengde. Oppløsningsmidlet som er igjen i bunnen av beholderen og ikke oppløses kalles bakgrunn kropp.
Overskudd av sukker i bunnen av glasset vil ikke oppløses og vil ikke påvirke konsentrasjonen av løsningen. Videre vil ikke sukkeret som er avsatt i bunnen av glasset gjøre vannet søtere.
Klassifisering av løsninger
Løsninger kan klassifiseres etter mengden oppløst løsemiddel. Dermed kan de være av tre typer: mettet, umettet og overmettet.
- mettet løsning: Løsningen har nådd grensen for løselighetskoeffisienten, det vil si at det er en maksimal mengde løst oppløst i løsningsmidlet ved en bestemt temperatur.
- umettet løsning: Mengden oppløst løsemiddel har ennå ikke nådd løselighetskoeffisienten. Dette betyr at mer løsemiddel kan tilsettes.
- overmettet løsning: Det er mer oppløst oppløst stoff enn under normale forhold. I dette tilfellet presenterer de et bunnfall.
For å lære mer om løsninger, les følgende tekster.:
- Fortynning av løsninger
- Molalitet
- Molaritet
- Titrering
Konsentrasjon av løsninger
Fra løsningsmidlet og løsningsmidlet er det mulig å beregne konsentrasjonen av en løsning.
Felles konsentrasjon er definert som forholdet mellom massen av oppløst stoff oppløst i et gitt oppløsningsvolum.
Konsentrasjonsberegning gjøres med følgende formel:
Å være,
Ç: Konsentrasjon (g / l);
m: masse av løsemiddel (g);
V: løsningsvolum (L).
Eksempel:
(Faap) Beregn konsentrasjonen, i g / l, av en vandig løsning av natriumnitrat som inneholder 30 g salt i 400 ml løsning:
Vedtak:
Følg informasjonen angående mengder løsemiddel og løsemiddel. Det er 30 g salt (oppløst stoff) i 400 ml vandig løsning (løsemiddel).
Volumet er imidlertid i ml, og vi må transformere det til L:
For å kjenne konsentrasjonen, må du bare bruke formelen:
Med dette resultatet kom vi til at når vi blander 30 g salt med 400 ml vann, vil vi oppnå en løsning med en konsentrasjon på 75 g / L.
For mer informasjon om hvordan du beregner den vanlige konsentrasjonen, vil disse tekstene være nyttige.:
- Løsningskonsentrasjon
- Øvelser på vanlig konsentrasjon