En tilleggsreaksjon er en kjemisk prosess der atomer av et uorganisk stoff tilsettes et organisk molekyl, som må ha en av følgende egenskaper:
Åpen struktur som inneholder binding eller pi lenker;
Mettet lukket struktur (bare med sigma lenker);
Lukket umettet struktur (med en pi eller aromatisk binding).
De organiske forbindelsene som har disse egenskapene er som følger Hydrokarboner:
alkener;
Alkynes;
Alkadienes;
Syklaner;
Sykler;
Aromater.
I løpet av en tilleggsreaksjon, en eller flere pi-obligasjoner, eller en sigma-binding (i det eksklusive tilfellet av en cyklan) er ødelagt forårsaker to eller flere frie valenser (bindingssteder) på de involverte karbonene, som i eksemplet nedenfor:
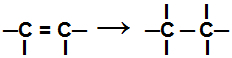
Bryte pi-bindingen i et alken
Etter at denne bindingen er brutt, må tilsetningen av atomer skje på de nye bindingsstedene som er opprettet i den organiske forbindelsen. Vi lister opp hvilke typer tilleggsreaksjoner som kan utføres med organiske forbindelser.
hydrogenering
I dette tilleggsreaksjon, i tillegg til den organiske forbindelsen, er den andre reaktanten hydrogengass (H
2). I hvert av karbonene, hvor splittelsen oppstår (brudd på sigma- eller pi-bindingen, som sett før), vil det være bindingen til et hydrogenatom som refererer til mengden av ødelagte bindinger.Når vi for eksempel utfører hydrogeneringen av syklobutan, brytes en sigmabinding mellom karbon 1 og 2. Deretter binder et hydrogenatom seg til hvert av disse karbonene:
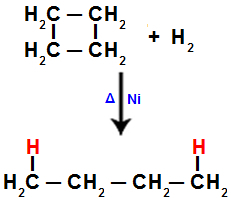
Ligning som representerer hydrogenering i syklobutan
Halogenering
I tillegg til den organiske forbindelsen, den andre reagensen i dette tilleggsreaksjon er et molekylært halogen (klor-Cl-gass2, fluor-F-gass2, fast jod-I2 og flytende brom-Br2). Ved hvert karbon, der fisjonen oppstår (brudd på sigma- eller pi-bindingen, som vist ovenfor), vil det være bindingen til et atom av halogen refererer til antall ødelagte forbindelser.
Når vi således utfører halogeneringen (ved bruk av klorgass) av cyklopropen, brytes pi-bindingen mellom karbon 1 og 2. Deretter binder et kloratom til hvert av disse karbonene:

Ligning som representerer halogenering i cyklopropen
Ikke stopp nå... Det er mer etter annonseringen;)
Tilsetningsreaksjon med halogenid
Et halogenid er en uorganisk hydra syre, dannet av et hydrogenatom og et hydrogenatom. halogen, slik som saltsyre (HCl), flussyre (HF), hydrobromsyre (HBr), syre hydroiodic (HI).
På tilleggsreaksjon med halogenid, i tillegg til den organiske forbindelsen, er det andre reagenset et halogenid, derav et av karbonene, hvor spaltning (brudd på sigma- eller pi-bindingen, som vist ovenfor), må motta hydrogenatomet, og den andre mottar halogenid.
Ifølge Markovnikovs styre, må det mest hydrogenerte karbonatomet (eller karbonet festet til en mindre radikal) motta hydrogen, og det mindre hydrogenerte karbonet (eller karbonet festet til en større radikal) må motta halogenid.
For eksempel når vi utfører denne reaksjonen på propen med saltsyre (HCl), brytes pi-bindingen mellom karbon 1 og 2. Deretter binder hydrogen til karbon 1 (mer hydrogenert) og klor til karbon 2 (mindre hydrogenert):
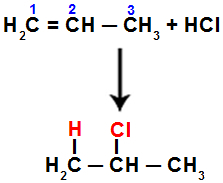
Ligning som representerer tilsetningen med halogenid i propen
Hydreringsreaksjon
Vannmolekylet, når det ioniserer, produserer hydroniumkation (H+) og hydroksydanionet (OH-). Av den grunn, i dette tilleggsreaksjon, i tillegg til den organiske forbindelsen, er den andre reaktanten vann. Dermed mottar ett av karbonene, hvor fisjonen oppstår (brudd på sigma- eller pi-bindingen, som vist ovenfor), hydroniumkationen, og den andre mottar hydroksidanionen.
I følge Markovnikovs regel er det mest hydrogenerte karbonatomet (eller karbonet festet til en mindre radikal) må motta hydronium, og mindre hydrogenert karbon (eller karbonet som er bundet til en større radikal) må motta hydroksid.
Når vi for eksempel hydrerer penta-1,4-dien, brytes pi-bindingen mellom karbon 1 og 2 og mellom karbon 4 og 5. Deretter mottar karbon 1 og 5 hydronium, og karbon 2 og 4 mottar hydroksidet:
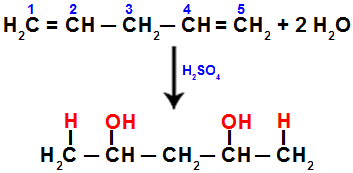
Ligning som representerer tilsetning med hydrering i penta-1.4 dien
Av meg. Diogo Lopes Dias