En blanding av oppløsninger av samme løsemiddel uten kjemisk reaksjon den består i å samle to løsninger med for eksempel kaliumklorid (Kcl) i samme beholder. I denne typen blanding vil det aldri være en kjemisk reaksjon på grunn av tilstedeværelsen av like oppløste stoffer, det vil si at begge har samme kation og samme anion. Dermed kan vi si at når vi utfører en blanding med disse karakteristikkene, legger vi bare til mengdene løsemiddel og løsemiddel som utgjør begge løsningene.
Hvis vi for eksempel blander en løsning av 1 liter vann og 4 gram KI (kaliumjodid) med en annen av 2 liter vann og 6 gram KI, har vi en ny løsning av 3 liter vann og 10 gram KI.
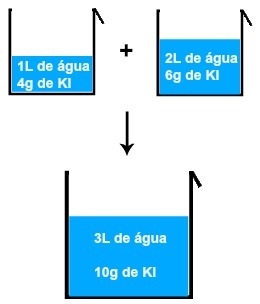
Resultat av blanding av to kaliumjodidløsninger
Når vi analyserer bildet, kan vi konkludere med det massen av det oppløste stoffet (m1') av den første løsningen tilsettes massen av det oppløste stoffet (m1'') av den andre løsningen, resulterer i massen av det oppløste stoffet (mF) i den endelige løsningen (Blande):
m1'+ m1'' = mF
I eksemplet:
4 + 6 = 10 gram
Det samme skjer med volumet av vann som er tilstede i hver løsning, det vil si at volumet av den første (V ') tilsatt til volumet av den andre (V' ') resulterer i det endelige volumet (V'F):
V '+ V' '= VF
I eksemplet:
1 + 2 = 3 L.
Siden hver løsning har en mengde oppløst oppløst stoff, og her har vi en blanding av oppløsninger med samme oppløsningsmiddel, Vi kan da, fra ovenstående, bestemme konsentrasjonen (vanlig, molaritet) av hver av de blandede løsningene og også for den endelige løsningen.
Derfor må vi huske formlene for å beregne disse konsentrasjonene:
Vanlig konsentrasjon:
C = m1
V
m1 = massen av løsningen oppløst
V = løsningsvolum
MERK: isolere m1 i formelen har vi: m1 = CV
Molaritet:
M = m1
M1.V
M1 = molær masse av det oppløste stoffet.
MERK: isolere m1 i formelen har vi: m1 = M.M1.V
Da blandingen av oppløsninger av samme løsemiddel adresserer summen av massen av løsningen av løsningen, kan vi erstatte hver av observasjonene i følgende uttrykk:
m1'+ m1'' = mF
C'.V '+ C' '. V' '= CF.VF
Ikke stopp nå... Det er mer etter annonseringen;)
C '= vanlig konsentrasjon av løsning 1
C '' = vanlig konsentrasjon av løsning 2
Hvis beregningen av blandingen av løsninger innebærer molaritet:
m1'+ m1'' = mF
M'.V '+ M' '. V' '= MF.VF
MERK: Siden løsningen er den samme, er molmassen den samme i hver av løsningene; derfor forsømmes det i beregningen.
nå se eksempler som dekker beregninger i en blanding av løsninger av samme løsemiddel uten kjemisk reaksjon:
Eksempel 1: (Mackenzie-SP-Adaptada) Tilsetning av 600 ml av en 14 g / L KOH-oppløsning til et bestemt volum (v) av 84 g / L-oppløsning av samme base, oppnås en 67,2 g / L-oppløsning. Det tilsatte volumet (v) av 84 g / L-oppløsningen er:
a) 0100 ml
b) 3000 ml
c) 2700 ml
d) 1500 ml
e) 1900 ml
Dataene som ble gitt av øvelsen var:
V '= 600 ml
C '= 14 g / l
V '' =?
C '' = 84 g / l
VF = ?
CF = 67,2 g / l
Før vi bestemmer det tilsatte volumet av løsning 1, må vi først bestemme det endelige volumet ved hjelp av følgende uttrykk:
V '+ V' '= VF
600 + V '' = V.F
Ved å erstatte verdiene gitt i det matematiske uttrykket nedenfor har vi:
C'.V '+ C' '. V' '= CF.VF
14. 600 + 84.V '' = 67,2. (600 + V '')
8400 + 84.V '' = 67,2. 600 + 67,2.V ''
8400 + 84.V '' = 40320 + 67.2.V ''
84.V '' - 67.2.V '' = 40320-8400
16.8.V '' = 31920
V '' = 31920
16,8
V '' = 1900 ml
Eksempel 2: (UFOP) I en 1000 ml målekolbe ble 250 ml av en 2M svovelsyreoppløsning tilsatt 300 ml av en 1M løsning av den samme syren, og volumet ble fylt opp til 1000 ml med destillert vann. Bestem molariteten til den resulterende løsningen.
Dataene som ble gitt av øvelsen var:
V '= 250 ml
M '= 2 M
V '' = 300 ml
M '' = 1 M
VF = 1000 ml
MF = ?
For å bestemme molariteten til den endelige løsningen, bruk bare det matematiske uttrykket som representerer prosessen:
M'.V '+ M' '. V' '= MF.VF
2. 250 + 1. 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0,8 mol / l
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Blanding av oppløsninger av samme løsemiddel uten kjemisk reaksjon"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Tilgang 27. juni 2021.