Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) var en italiensk kjemiker som først etablerte ideen om at en prøve av et element, med masse i gram numerisk lik atommassen, har alltid samme antall atomer (N).
Avogadro selv var ikke i stand til å bestemme verdien av N. Gjennom hele det tjuende århundre gjorde utviklingen av teknologi og vitenskapelig kunnskap det imidlertid mulig for andre forskere å utvikle teknikker for å bestemme det. Da denne verdien endelig ble oppdaget, ble den kalt Avogadro er konstant, til ære for denne forskeren, som det var han som la grunnlaget for dets opprettelse.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
I 1 mol av en hvilken som helst enhet (atomer, molekyler, elektroner, formler eller ioner) er det nøyaktig verdien av Avogadros konstant.
Tabellen nedenfor viser noen verdier for Avogadros konstant oppnådd gjennom det 20. århundre:
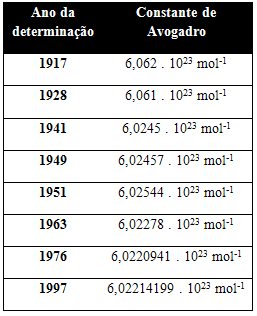
Her er noen av teknikkene som brukes til å prøve å bestemme verdien av Avogadros konstant:
Den første forskeren som gjorde en omtrentlig beregning for Avogadros konstant, var Johann Joseph Loschmidt. I 1867 baserte han seg på den kinetiske teorien om gasser og bestemte hvor mange molekyler som fantes i 1 cm
3 av en gass.En annen av disse forskerne var franskmannen Jean Baptiste Perrin (1870-1942) som tellet antall kolloidale partikler per volumsenhet i en suspensjon og målte massene. Verdien han fant var mellom 6,5 og 7,2. 1023 enheter per mol. Denne vitenskapsmannen ga ut boken i 1913 Les Atomes (1. utg. Paris: Alcan), og den 9. utgaven, utgitt i 1924, inneholdt 16 måter å eksperimentelt oppnå Avogadros konstant.
Ikke stopp nå... Det er mer etter annonseringen;)

Jean Baptiste Perrin (1870-1942)
År senere brukte forsker James Dewar (1842-1923) en metode utviklet mange år tidligere av radiokjemiker Bertram Boltwood (1870-1927) og fysiker Ernest Rutherford (1871-1937), som i utgangspunktet besto av å telle alfapartiklene som sendes ut av en radioaktiv kilde og bestemme volumet av heliumgass oppnådd. Verdien funnet av Dewar var 6.04. 1023 mol-1.
Tilbake i det 20. århundre gjennomførte Robert Millikan (1868-1953) et eksperiment for å bestemme ladningen til elektronet (1.6. 10-19 Ç). Siden ladningen på 1 mol elektroner allerede var kjent (96500 C), var det mulig å relatere disse to verdiene og finne følgende verdi for Avogadros konstant: 6,03. 1023 mol-1.
For tiden er den anbefalte verdien for Avogadros konstant 6.02214 x 1023 mol-1 og det bestemmes ved hjelp av røntgendiffraksjon, hvor volumet av noen få atomer av et krystallinsk gitter oppnås, så lenge tettheten og massen av 1 mol atomer i prøven er kjent.
For didaktiske formål, på videregående skole, der beregningene ikke trenger å være så nøyaktige som de som ble utført i kjemiske laboratorier, blir Avogadros konstant ansett som 6,02. 1023 mol-1.
Det er også enklere metoder som kan brukes til å hjelpe studentene til å bestemme Avogadros konstant i praksis. En av dem er gjennom elektrolyse i et vandig medium.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Bestemmelse av Avogadros konstant"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Tilgang 28. juni 2021.

