Joseph Lous Gay-Lussac (1778-1850) var en forsker som gjorde viktige studier av gasser. Han utførte produksjonen av vann fra reaksjonen mellom hydrogen og oksygengasser og verifiserte at de reagerte alltid i forholdet mellom to volum hydrogen og ett volum oksygen, og produserte to volum Vann:
Hydrogen + Oksygen → Vann
1. eksperiment: 2 l 1 l 2 l
2. eksperiment: 4 L 2 L 4 L.
3. eksperiment: 8 L 4 L 8 L.
4. eksperiment: 16 L 8 L 160 L
Merk at i alle eksperimenter er forholdet alltid det samme: 2: 1: 2.
Etter flere eksperimenter og analyser, innså at det samme skjedde med andre typer reaksjoner mellom gasser, det vil si reaksjonene alltid fulgt et konstant volumforhold, kom denne forskeren fram til følgende lov om reaksjoner i gassformige volumer, kjent som Gay-Lussac volumetrisk lov eller Lov om kombinasjon av volumer:

Erklæring om Gay-Lussac volumetriske lov
Men denne loven var imot Daltons atomteori, som sa at alt var dannet av massive og udelelige sfæriske partikler, atomene. I følge denne teorien skal volumet av produktene i reaksjonen være lik summen av volumene til reaktantene. Dermed bør følgende forekomme:
Hydrogen + Oksygen → Vann
2 bind + 1 bind → 3 bind
Men Gay-Lussac viste at dette ikke var tilfelle i praksis, resultatet var lik to volumer vanndamp.
Svaret på denne tilsynelatende motsetningen kom gjennom hypotese eller Avogadros lov.

Frimerke trykt i Italia viser Amedeo Avogadro og oppsigelsen av hans lov i 1956 *
Amedeo Avogadro (1776-1856) viste at gasser i virkeligheten ikke var isolerte atomer, men molekyler (med unntak av edelgasser). Hans lov sa:

Avogadros lovuttalelse
Avogadro viste det 1 føflekk av hvilken som helst gass har 6.02. 1023 molekyler. Denne verdien er kjent som Avogadros tall eller konstant. Det ble bevist at, under normale forhold for temperatur og trykk (CNTP), der trykket er lik 1 atm og temperaturen er 273 K (0 ° C), volumet opptatt av 1 mol av en hvilken som helst gass vil alltid være 22,4 L. Denne verdien tilsvarer molar volum av gasser. Disse forholdene er veldig viktige for å løse øvelser av støkiometri.
Dette kan virke rart, ettersom følgende spørsmål kan oppstå: Hvordan kan gasser med molekyler og atomer av forskjellige størrelser oppta samme volum?
Vel, dette er fordi gassmolekylene er så langt fra hverandre at størrelsen på molekylene er ubetydelig.
På denne måten forklarte Avogadros volumetriske lov Gay-Lussacs volumetriske lov. Legg merke til nedenfor at to hydrogenmolekyler (to volumer) reagerer med ett oksygenmolekyl (ett volum) for å danne to vannmolekyler (to volum). Vann og hydrogen har samme volum fordi de har samme mengde molekyler, som det fremgår av Avogadros lov.
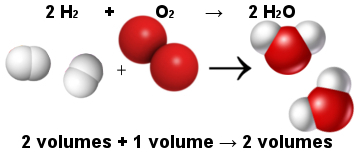
Andel mellom molekyler i vanndannelsesreaksjonen
Samtidig gjorde loven til Avogadro atomteorien, da du ser at i både reaktanter og produkter er det totalt 6 atomer (4 hydrogen og 2 oksygen).
Disse volumetriske lovene var veldig viktige for utviklingen av begrepet molekyler.
* Opphavsrettsbeskyttet bilde: rook76 / Shutterstock.com
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm
