Sulfoneringsreaksjoner i alkaner de er organiske substitusjonsreaksjoner, utført med sikte på å produsere sulfonsyrer (organiske forbindelser som har SO-gruppen3H festet til et karbonatom eller til en karbonkjede) og vann (H2O).
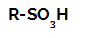
Strukturformel av en sulfonsyre
For å utføre en sulfoneringsreaksjon på alkaner, må vi blande en alkan (forbindelse dannet av en karbonkjede mettet med bare karbon og hydrogenatomer) og svovelsyre (H2KUN4konsentrert, utsatt for oppvarming (∆).
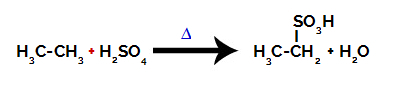
Kjemisk ligning som representerer sulfoneringen av en to-karbon alkan
Prinsipper for sulfoneringsreaksjonen i alkaner
Som for eksempel alkan sulfoneringsreaksjon det er en substitusjonsreaksjon, vi har en utveksling mellom mindre komponenter elektronegativitet av reaktantene, det vil si mellom alkan og svovelsyre. Alkan har hydrogen og svovelsyre, sulfongruppen.
Nedenfor har vi trinn for trinn mekanismen til a sulfoneringsreaksjon i alkaner. Som et eksempel vil vi bruke det enkleste alkanet, metan (CH4):
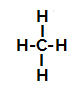
Strukturformel av metan
Første trinn: Forstyrrelse av bindingen mellom hydroksyl (OH) og svovel (S) i svovelsyre.
Hver hydroksylgruppe som er tilstede i svovelsyre er preget av å være mer elektronegativ. Ved oppvarming under reaksjonen er tendensen at bindingen mellom hydroksylgruppen og svovelet brytes:
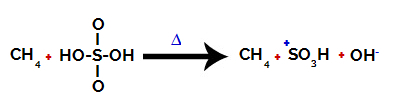
Forstyrrelse av bindingen mellom svovel og hydroksyl
Bruddet på bindingen til alle hydroksyler skjer imidlertid ikke på grunn av den elektroniske omleggingen i strukturen. Deretter oppnås et hydroksydanion (OH).-) og et sulfonisk kation.
Andre trinn: Hydroksylgruppeangrep på alkanmolekylet.
Deretter hydroksygruppen (OH-) utfører et angrep på alkanen og forårsaker at bindingen mellom karbon og hydrogen (som er mer skjør på grunn av forskjellen i elektronegativitet mellom dem) blir brutt.
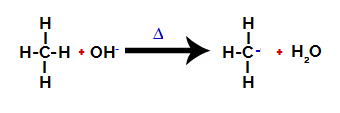
Bryte båndet mellom karbon og hydrogen i alkan
Merk: Forstyrrelse av bindingen mellom karbon og hydrogen vil alltid forekomme hyppigst ved karbon med lavere elektronisk tetthet eller ladning. Jo færre hydrokarboner karbon har, eller jo flere grupper som er knyttet til det, jo lavere er dens elektrontetthet. Så vi har:
Tertiært karbon
Etter at bindingen er brutt, blir alkanen et elektronmangel karbon (karbokasjon). Hydroksydgruppen (OH)-) samhandler med frigjort hydrogen og danner et vannmolekyl.
Tredje trinn: Angrep av den dannede radikalen på sulfongruppen.
Til slutt angripes sulfongruppen av resten av alkanen og danner en sulfonsyre.
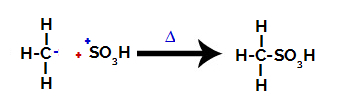
Strukturer som samhandler og danner sulfonsyre
Eksempler på ligninger som representerer sulfoneringsreaksjoner i alkaner
Første eksempel: Sulfonering av propan.
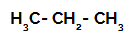
Strukturformel av propan
Propan har to primære karbonatomer og ett sekundært karbon, som har forskjellige ladninger fordi de er bundet til forskjellige mengder hydrogen. Siden karbon er mer elektronegativ enn hydrogen, har disse karbonene forskjellige elektrontettheter.
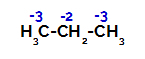
Fordeling av ladninger på hvert karbonatom av propan
På primære karbon er ladningen -3 (fordi den er bundet til tre hydrogener), og på det sekundære karbonet er ladningen -2 (fordi den er bundet til to hydrogener). Dermed vil det være et brudd i bindingen mellom karbon og hydrogen, noen ganger ved karbon 1 (av ett molekyl), noen ganger for karbon 2 (for et annet molekyl).
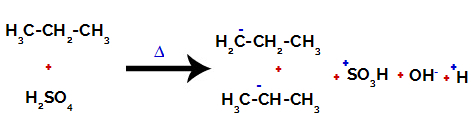
Å bryte båndet mellom karbon og hydrogen på forskjellige karbonatomer
Etter bruddene mellom bindingene, både i svovelsyre og i alkan, er det dannelsen av produkter med erstatning av hydrogen på karbon 1 med en sulfongruppe, og det samme skjer på karbon 2.
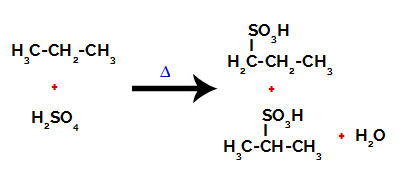
Produkter dannet ved sulfonering av propan
Andre eksempel: Sulfonering av 2-metyl-butan.

Strukturformel av 2-metyl-butan
2-metylbutan har tre primære karbon, et sekundært karbon og et tertiært karbon, som har forskjellige ladninger og følgelig forskjellige elektroniske tettheter, som det fremgår av følgende struktur:
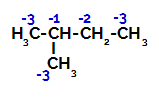
Fordeling av elektroniske ladninger i 2-metyl-butan
Derfor er det i 2-metyl-butan flere muligheter for å bryte bindingen mellom karbon og hydrogen, som kan forekomme på karbon 1 (av et molekyl), karbon 2 (av et annet molekyl), karbon 3 eller karbon 4. Det er imidlertid bemerkelsesverdig at forstyrrelsen ved karbon nummer 2 er mer vanlig.
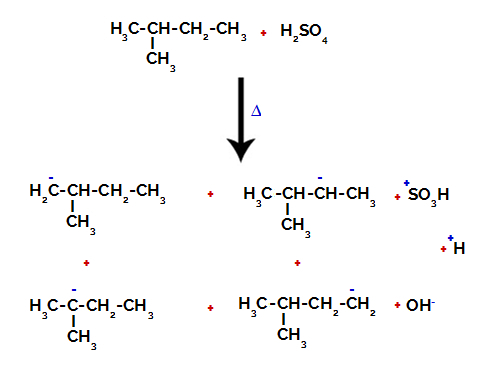
Å bryte båndet mellom karbon og hydrogen på forskjellige karbonatomer
Etter bruddet mellom bindingene, både i svovelsyre og alkan, dannes produkter med erstatning av hydrogen på karbon 1 med en sulfongruppe, og det samme skjer på karbon 2.

Produkter dannet ved sulfonering av 2-metyl-butan
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm