I teksten "Tittel eller masseprosent”Vi så hvordan vi skal beregne forholdet mellom massen av løsemidlet og massen av løsningen, for faste, flytende og gassformige løsninger. I denne teksten vil vi imidlertid se at det også er mulig å beregne titer volummessig, for løsninger med flytende eller gassformige komponenter.

Tittelen i volum kan beregnes med uttrykket:
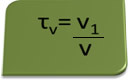
Tenk som et eksempel på en vandig løsning av etylalkohol brukt som et antiseptisk og desinfiserende middel tilberedt ved å tilsette 70 ml ren alkohol i nok vann til å fylle opp til et volum på 100 ml løsning. Så vi har:
τ = 70 ml = 0,7
100 ml
Vi kan også uttrykke tittelen i prosent, bare multiplisere resultatet med 100%. Så i dette tilfellet har vi en 70% etylalkoholoppløsning, noe som betyr at av hver 100 volumenheter av løsningen er 70 volumenheter alkohol.
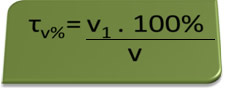
I tilfelle nedenfor har vi en 70% etylalkoholoppløsning i et 250 ml oppløsningsvolum; som betyr at 175 ml er alkohol, ifølge beregningene:
100 ml 70 ml alkohol
250 ml x
x = 70. 250
100
X = 175 ml alkohol

Vi kan imidlertid ikke si at vi i dette tilfellet har 75 ml (250-175) vann. I motsetning til massetiter, der vi kan tilsette løsemiddelmassen til løsemassen for å finne løsningsmassen, kan dette ikke gjøres i forhold til volumetiter.

Dette betyr at løsningsvolumet ikke er lik summen av løsningsmiddelvolumet og det oppløste volumet (selv om forskjellen ofte kan betraktes som ubetydelig). Dette er fordi de intermolekylære kreftene som finnes i disse væskene påvirker sluttvolumet.
I tilfellet med den ovennevnte løsningen, av etylalkohol, for eksempel når vi blander alkohol med vann, er det en sammentrekning av det totale volumet av løsningen; det vil si at det endelige volumet vil være mindre enn om vi tilsatte volumet alkohol og vann alene. Dette er fordi alkoholmolekylene etablerer bindinger eller hydrogenbindinger med vannmolekylene, og reduserer mellomrommene mellom dem.
Derfor, i dette og andre tilfeller, må løsningsvolumet måles eksperimentelt når det ikke er gitt i øvelsen.
Prosentandelen av volum er mye brukt i tilfeller av alkoholholdige drikkevarer og kommersiell alkohol, som nevnt ovenfor. Se to viktige anvendelser av denne beregningen:
- Åndedrettsvern: åndedrettsvern måler konsentrasjonen av etylalkohol i blodet, og i Brasil er det forbudt for noen å kjøre noen type kjøretøy med et alkoholinnhold i blod som tilsvarer eller over 0,1 volum%. En person med dette alkoholinnholdet har, for hver liter blod, 1 ml alkohol, som vist i følgende beregninger:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 ml
100%

- Etanolinnhold i bensin: i Brasil reguleres bensin ved tilsetning av etanol. Men etanolinnholdet i bensin må maksimalt være 24 volum% vannfri alkohol (siden bensin må være vannfri). Jo mer etanol tilsettes bensin, jo mer blir drivstoffets farge lysere og densiteten øker.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm
