O vinylklorid det er en hydrokarbon giftig klorert og kreftfremkallende virkning. Det er en fargeløs gass ved romtemperatur, som er svært brannfarlig og følsom for varme.
Det er monomeren som brukes til fremstilling av polyvinylklorid, et stoff kjent som PVC. O PVC er en varmebestandig termoplast (i motsetning til monomeren) som har mange bruksområder i hverdag, som belegg av elektriske ledninger, konstruksjon av rør og ulike typer emballasje.
Les også:Asbest - naturlig fiber med bred industriell anvendelse, men ekstremt giftig for mennesker
Sammendrag om vinylklorid
Vinylklorid er et klorert hydrokarbon med formelen H2C=CHCl.
Det er en gass fargeløs, søttluktende og svært brannfarlig.
Vinylklorid er ustabil til varme, gjennomgår nedbrytning.
Hovedanvendelsen av vinylklorid er i produksjonen av polyvinylklorid (PVC).
PVC er en termoplast med mange bruksområder, som rør, deler, belegg, emballasje, etc.
Vinylklorid er giftig og har en kreftfremkallende effekt.
vinylkloridegenskaper
molekylær formel: CH2CHCl (C2H3Cl).
Molekylmasse: 62,498 g/mol.
fysisk tilstand: gass (fargeløs og med sterk lukt).
Tetthet: 0,91 g/ml.
Løselighet i vann: svært lite løselig (0,6 g i 100 ml vann, 20 °C).
smeltepunkt: -154°C.
Koketemperatur: -13°C.
Hva er vinylklorid?
Vinylklorid er et klorert hydrokarbon med formelen H2C=CHCl. Ved romtemperatur oppstår det med en Fargeløs og svært brannfarlig gass.
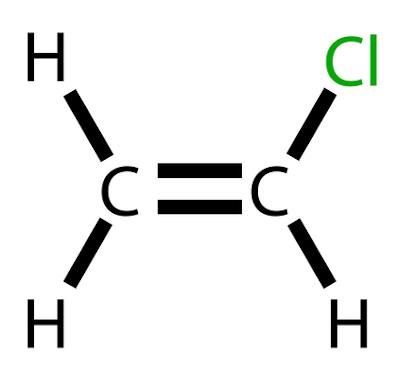
Vinylklorid, også kalt kloreten eller vinylkloridmonomer, er en kjemiske produkter av stor betydning i industri, som har spesiell anvendelse ved fremstilling av polymer polyvinylklorid, bedre kjent som PVC. Denne forbindelsen opptar listen over de 20 produktene som kommer fra Petroleum av større industriell og økonomisk relevans.
Les også:Benzopyren - kreftfremkallende hydrokarbon som finnes i sigarettrøyk og grillet kjøtt
Egenskaper av vinylklorid
Vinylklorid er en Fargeløs gass med en mild, søt lukt. Det har egenskapen å være svært brannfarlig.
Når de utsettes for varmekilder, kan gjennomgå dekomponering og avgir giftige damper i karbondioksid, karbonmonoksidhydrogenklorid og fosgen. Fordi det er en organisk forbindelse er løseligheten i vann ekstremt lav, derimot er den løselig i stoffer som f.eks. etanol, benzen og karbontetraklorid.
I nærvær av fuktighet blir vinylklorid etsende og kan angripe jern og stål. Den har kapasitet til å polymerisere når den utsettes for varme i atmosfærisk luft, gjennom en eksoterm reaksjon. Denne egenskapen har mange av sine industrielle anvendelser.
Vinylklorid krever oppmerksomhet pga det er giftig og kreftfremkallende.
Hva brukes vinylklorid til?
Vinylklorid er monomer som brukes til å produsere PVC-polymer (polyvinylklorid) og andre klorerte løsningsmidler.
PVC er en termoplast som brukes til fremstilling av emballasje, fottøy, elektriske koblinger og kabler, piper, vinduer, tuber og blodoppsamlingsposer, plagg, blant utallige andre gjenstander.

O PVC dannes ved polymerisering av vinylklorid. I denne kjemiske prosessen legger et stort antall vinylkloridmolekyler til hverandre, og danner en stor kjemisk struktur.
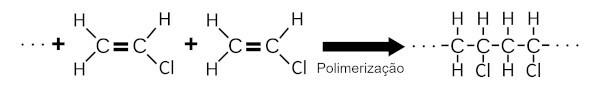
O PVC er flammehemmende og av denne grunn er det mye brukt i belegg av ledninger, elektriske kabler og boligbelegg.
Selv om vinylklorid er en kjemisk forbindelse som krever oppmerksomhet på grunn av sin toksisitet og termisk ustabilitet, PVC-polymeren er veldig stabil overfor varmekilder, den er giftfri og kan lagres med sikkerhet.
Fram til 1974 ble vinylklorid brukt i aerosoler. Tidligere ble det til og med brukt som inhalasjonsbedøvelse. Med kunnskap om toksisiteten til denne forbindelsen, ble disse applikasjonene avviklet.
Innhenting av vinylklorid
Syntesen av vinylklorid brukt i industriell skala er initiert med forbindelsen etylen eller eten (CH2=CH2) og kan skje via to ruter.
I den første omdannes etylen til 1,2-dikloretan ved reaksjon med klorgass. Deretter, ved å varme opp 1,2-dikloretanet i nærvær av en katalysator, oppnås vinylklorid som hovedprodukt og saltsyre som et sekundært produkt.
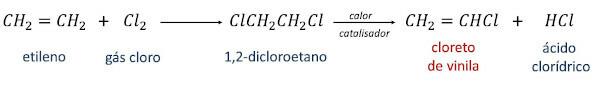
I den andre reaksjonsveien, kjent som oksyklorering, er reaksjonen mellom etylen, saltsyre og oksygen fra selve atmosfæren, i nærvær av varme og en katalysator, og genererer vinylklorid og vann som produkter.

Vanligvis er et vinylkloridproduksjonssenter bygget for å imøtekomme begge produksjonsprosessene. sitert, slik at saltsyren generert i den første metoden fungerer som et reagens for å utføre den andre rute.
Forholdsregler med vinylklorid
Vinylklorid er en giftig forbindelse. Siden det er en gass, Hovedformen for forurensning er ved innånding., og derfor må håndteringen alltid gjøres med bruk av egnet utstyr, for eksempel gassmasker.
Eksponering for dette stoffet påvirker nervesystemet perifere og sentrale, forårsaker skade på lever. EN Kontinuerlig eksponering kan utløse Raynauds fenomen, som er et sett med symptomer som inkluderer ledd- og muskelsmerter og hudforandringer, som kan utvikle seg til fullstendig tap av hudens elastisitet, til og med påvirke organer indre organer og blodårer.
Andre effekter inkluderer eufori, desorientering, spontanabort og fødselsskader. Skader på øyevev registreres også.
Symptomer avhenger av eksponeringsnivået for stoffet, alt fra svimmelhet, kvalme, synsforstyrrelser, hodepine og ataksi ved akutt eksponering (fra 1000 til 8000 ppm vinylklorid i luft), til narkotisk effekt, hjertearytmi og dødelig respirasjonssvikt ved eksponering for nivåer over 12000 ppm.
Vinylklorid og kreft
O vinylklorid er et kreftfremkallende stoff, assosiert med høy risiko for å utvikle leverkreft, som kan bidra til forekomster av hjernekreft og lunge, samt kreft i lymfesystemet.
Les også:Ammoniumnitrat — forbindelse som brukes i landbruket som kan forårsake eksplosjoner
Forekomst av vinylklorid
vinylkloridet genereres spontant i miljøet gjennom dekomponering av noen forbindelser som inneholder klorgjennom virkningen av mikroorganismer. Derfor kan det betraktes som en luft- og vannforurensning, spesielt i regioner nær søppelfyllinger.
Imidlertid er den høyeste forekomsten av vinylklorid via syntetiske ruter, relatert til kjemisk industri, som tidligere diskutert.
Historien om vinylklorid
Vinylklorid var oppdaget i 1835 av den tyske kjemikeren Justus von Liebig, ved omsetning av dikloretan med kaliumhydroksid i et alkoholholdig miljø.
Senere, i 1872, observerte kjemikeren Eugen Baumann for første gang polymeriseringen av vinylklorid, med opprinnelse av PVC, etter å ha forlatt en beholder med stoffet utsatt for solen ved et uhell.
I 1926 oppdaget den amerikanske oppfinneren Waldo Semon kjemiske tilsetningsstoffer som ga større elastisitet og formbarhet til PVC, og utvidet bruksmulighetene til dette stoffet. Rundt 1950 begynte PVC å bli brukt i industriell skala. For tiden er PVC en av de mest brukte termoplastene i verden.
Av Ana Luiza Lorenzen Lima
Kjemilærer
Kilde: Brasil skole - https://brasilescola.uol.com.br/quimica/cloreto-de-vinila.htm

