DE periodisk klassifisering av grunnstoffer ble foreslått i 1913 av Henry Monseley (1887-1915), som identifiserte den periodiske variasjonen til mange egenskaper med jevne mellomrom i henhold til antall protoner i kjernen til et grunnstoffs atom kjemisk.
På grunn av Lov om periodisitet, kriteriet som brukes til å organisere elementene i det gjeldende periodiske systemet er den stigende rekkefølgen av atomnummer (Z).
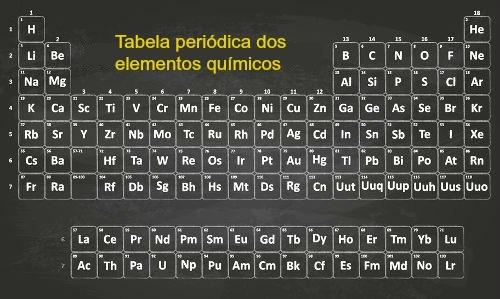
De 118 kjemiske grunnstoffene er ordnet i grupper og perioder i det periodiske system. I henhold til de fysiske og kjemiske egenskapene er det mulig å skille mellom metaller, ikke-metaller (ikke-metaller) og halvmetaller (metalloider).

De vertikale linjene er 18 grupper tabellen og samle elementer med lignende kjemiske egenskaper. De horisontale linjene tilsvarer 7 perioder og presenterer elementene med samme antall elektroniske lag.
Hydrogen er et grunnstoff som er plassert over gruppe 1 på grunn av sin elektroniske distribusjon, men det har ingen fellestrekk med dem.
Sjekk ut Periodiske tabell komplett og oppdatert.
metaller
De fleste kjemiske grunnstoffene i det periodiske systemet er klassifisert som metaller. De viktigste egenskapene til metaller er:
- De har en karakteristisk glans;
- De er tette, formbare og formbare;
- De er gode ledere av elektrisitet og varme;
- De er tilstede under omgivelsesforhold i fast tilstand, med unntak av kvikksølv.
De metalliske elementene i det periodiske systemet er:
alkalimetaller (gruppe1): litium, natrium, kalium, rubidium, cesium og francium.
jordalkalimetaller (gruppe 2): beryllium, magnesium, kalsium, strontium, barium og radium.
Representantsaker, i tillegg til elementene i gruppe 1 og 2, er: aluminium, gallium, indium, thallium, nion, tinn, bly, flerovium, vismut, muscovium og livermorium.
Ytre overgangsmetaller er elementene som opptar den sentrale delen av det periodiske systemet:
- Gruppe 3: skandium og yttrium.
- Gruppe 4: titan, zirkonium, hafnium og rutherfordium.
- Gruppe 5: vanadium, niob, tantal og dubnium.
- Gruppe 6: krom, molybden, wolfram og sjøborgium.
- Gruppe 7: mangan, technetium, rhenium og bohrium.
- Gruppe 8: jern, rutenium, osmium og hassium.
- Gruppe 9: kobolt, rhodium, iridium og meitnerium.
- Gruppe 10: nikkel, palladium, platina, darmstadium.
- Gruppe 11: kobber, sølv, gull og røntgen.
- Gruppe 12: sink, kadmium, kvikksølv og copernicium.
Interne overgangsmetaller er grunnstoffene som er en del av gruppe 3 og tilsvarer elementene i lantanid- og aktinidserien.
Lantanidserien består av lantan, cerium, praseodym, neodym, promethium, samarium, europium, gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium og lutetium.
Aktinidserien inneholder grunnstoffene aktinium, thorium, protactinium, uran, neptunium, plutonium, americium, curium, berkelium, californium, einsteinium, fermium, mendelevium, nobelium og laurence.
Les mer om alkalimetaller.
ikke-metaller
Ikke-metaller er plassert i høyre del av det periodiske systemet og har motsatte egenskaper til metaller, for eksempel:
- De har ikke et skinnende utseende;
- De er ikke gode ledere av elektrisitet og varme, så de brukes som isolatorer;
- De har lave koke- og smeltepunkter, så mange finnes i naturen i flytende tilstand.
Du ikke-metalliske elementer i det periodiske systemet er: hydrogen, nitrogen, oksygen, karbon, fosfor, selen, svovel, halogener og edle gasser.
Du halogener er grunnstoffene som tilhører gruppe 17: fluor, klor, brom, jod, astatin, tenessine og edelgassfamilien.
Du edle gasser er grunnstoffene som tilhører gruppe 18: helium, neon, argon, krypton, xenon, radon, oganesson.
Lær mer om edle gasser og halogener.
halvmetaller
Halvmetallene eller metalloidene er: bor, silisium, germanium, arsen, antimon, tellur og polonium. Disse elementene har egenskaper som er mellomliggende mellom metaller og ikke-metaller.
Les også om familier i periodiske tabeller.
Representative og overgangselementer
En annen måte å klassifisere elementer er ved å dele dem inn i representative og overgangselementer i henhold til elektronisk distribusjon av atomet.

Du representative elementer er de som har den elektroniske konfigurasjonen som slutter med det mest energiske undernivået i s (gruppe 1 og 2) eller til (gruppe 13, 14, 15, 16, 17 og 18).

Du overgangselementer er delt inn i ytre overgang, med de elementene som har det mest energiske elektronet på undernivået d og de av indre overgang, hvor det mest energiske elektronet er på et undernivå f.

Få mer kunnskap med innholdet:
- periodiske egenskaper
- Periodiske øvelser
- Øvelser om organisering av det periodiske system