En oksidasjonsreduksjonsreaksjon er karakterisert som en samtidig prosess med tap og gevinst av elektroner, ettersom elektronene som er tapt av et atom, ion eller molekyl, blir umiddelbart mottatt av andre.
For å forstå, se et eksempel:
En kobbersulfatløsning (CuSO4 (aq)) er blå på grunn av tilstedeværelsen av Cu-ion2+ oppløst i den. Hvis vi setter en metallisk sinkplate (Zn(s)) i denne løsningen, over tid vil vi kanskje merke to endringer: fargen på løsningen blir fargeløs og en metallisk kobberavsetning vises på sinkplaten.
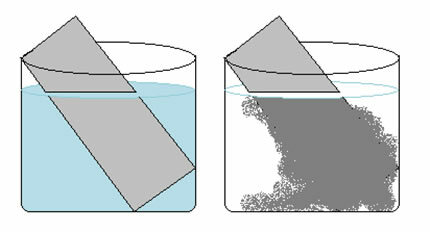
Derfor er reaksjonen som oppstår i dette tilfellet som følger:
Zn(s) + CuSO4 (aq) → Cu(s) + ZnSO4 (aq)
eller
Zn(s) + Cu2+(her) + OS42-(her) → Cu(s) + Zn2+(her) + OS42-(her)
eller ennå
Zn(s) + Cu2+(her) → Cu(s) + Zn2+(her)
Merk at det var en overføring av elektroner fra sink til kobber. Ved å analysere transformasjonen som skjedde i hvert av disse elementene isolert, har vi:
- Zn(s) → Zn2+(her)
Sink mistet 2 elektroner som gikk fra metallisk sink til kation. I så fall, sinket har gjennomgått en oksidasjon.
- Ass2+(her) → Cu(s)
Med kobber skjedde det motsatte, det fikk 2 elektroner, som gikk fra kobber II-kation til metallisk kobber. Kobber er redusert.
Dette forklarer de to endringene som ble observert, da løsningen ble fargeløs fordi kobberionene ble transformert til metallisk kobber, som ble avsatt på sinkplaten.
Ikke stopp nå... Det er mer etter annonseringen;)
Siden det var samtidig tap og gevinst av elektroner, er denne reaksjonen et eksempel på en redoksreaksjon, og gjennom det kan vi etablere følgende konsepter som gjentas for alle andre reaksjoner av dette type:

Det mest reaktive metallet gjennomgår oksidasjonI det foreslåtte eksemplet er sink således mer reaktivt enn kobber.
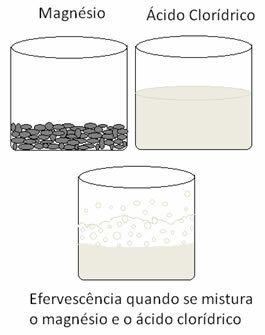
En annen redoksreaksjon som kan siteres, oppstår når vi legger magnesium eller aluminium i en saltsyreoppløsning. I disse reaksjonene mottar hydrogen fra saltsyre 3 elektroner fra aluminium (eller 2 elektroner fra magnesium), og sender det fra H-kation+ for hydrogengass (H2), mens metallet blir kationet:
2 Al(s) + 6 H+(her) → 2 Al3+(her) + 3H2 (g)
mg(s) + 2 H+(her) → Mg2+(her) + H2 (g)
Metaller gjennomgår oksidasjon og hydrogen gjennomgår reduksjon. Nedenfor er en figur som viser at tilsetning av magnesium til saltsyre forårsaker a brus, som skyldes frigjøring av hydrogengass, og magnesium forsvinner, som det er forbrukes.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Oksidasjonsreaksjoner"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Tilgang 28. juni 2021.
Kjemi
Drift av kollisjonsputen, enhet designet for å beskytte drivere, elektrisk impuls, kjemisk nedbrytningsreaksjon, kollisjon, kjemisk blanding av natriumazid, sensorer plassert på bilfanger, alkalisilikat, gass nitrogen.
Kjemi

Lysfølsomme linser, oksidasjonsreduksjonsreaksjoner, tap eller gevinst av elektroner, fotosyntetiske linser i solbriller, sammensetning av fotokromatisk glass, tetraedrale oksygenatomer, krystallstruktur av sølvklorid, ultrafiolett lys, sølvmetall



