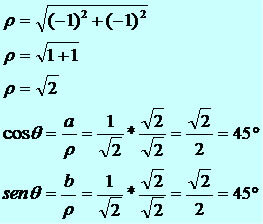Det kan skje at det er syrer av samme element, og dette elementet har samme oksidasjonsnummer (NOX), men forskjellen er i hydratiseringsgradene.
For eksempel nedenfor har vi tre syrer dannet av grunnstoffet fosfor (P):
H3STØV4 H4P2O7 HPO3
Merk at i alle tre syrene er oksidasjonsantallet av fosfor +5; forskjellen er i hydratiseringsgraden.
Basert på dette er disse syrene differensiert i nomenklaturen gjennom prefiksene orto, pyro og meta.
Den mest hydratiserte syren kalles orto. I eksemplet gitt er den første (H3STØV4) er kalt syre ortofosforsyre, fordi det er den mest hydratiserte av de tre. Orto-prefikset kan brukes, så det meste av tiden vil denne syren bare kalles fosforsyre.
Prefiksene pyro og meta brukes med ortosyre som referansepunkt:
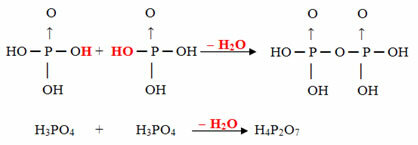
- Pyrus: 2 molekyler orto minus 1 molekyl H2O
Eksempel: H4P2O7 er kalt syre pirofosforsyre fordi det er lik to molekyler ortofosforsyre (H3STØV4) minus ett vannmolekyl.
2. H3STØV4 = H6P2O8
H6P2O8 - H2O = H4P2O7
Denne prosessen er en intermolekylær dehydrering:
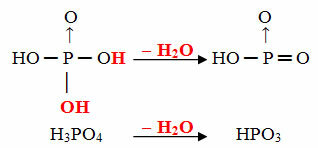
- Mål: 1 molekyl orto minus 1 molekyl H2O
Eksempel: HPO3 er kalt syre målfosforsyre fordi det er lik et molekyl ortofosforsyre (H3STØV4) minus ett vannmolekyl.
H3STØV4 - H2O = HPO3
Denne prosessen er en intramolekylær dehydrering:
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm