Overflatespenning er et fenomen som oppstår på overflaten av væsker, som vann, og danner en tynn film.
Når vann, i flytende tilstand, opptar en beholder, kan vi oppleve skillet mellom væsken og miljøet. Dette er fordi interaksjonen mellom vannmolekyler på overflaten er forskjellig fra interaksjonene inne i væsken.
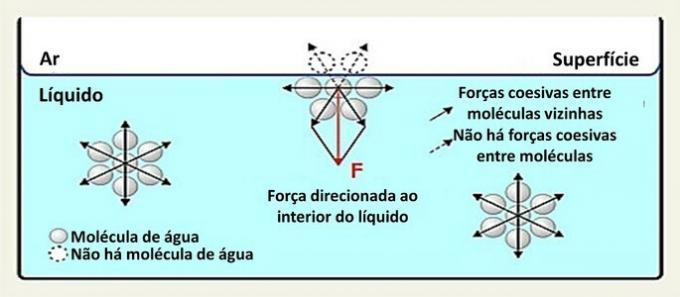
På overflaten samhandler et vannmolekyl med molekylene på sidene og under det. Innvendig er et molekyl omgitt av andre molekyler, og det er interaksjon i alle retninger gjennom hydrogenbindinger.
Det er på grunn av denne egenskapen at vi observerer fenomenet dannelse av en dråpe. På grunn av dette er det også mulig for insekter å gå på vann.
Hva er overflatespenning?
Det er dannelsen av en tynn film under en væske på grunn av ulikheten i attraksjoner mellom molekylene som utgjør den. Dette fenomenet forekommer mer markant i væsker som har intermolekylære krefter intens, som vann.
Interaksjoner mellom arter i en væske kalles sammenhengende krefter. Mens molekyler inne i en væske tiltrekkes av nærliggende molekyler i alle retninger, interagerer molekyler på overflaten med molekylene under og ved siden av dem.
Se hvordan overflatespenning oppstår i vann.
Vannet (H2O) er et polært molekyl dannet av 2 hydrogenatomer (positive poler) og ett oksygenatom (negativ pol) forbundet med kovalente bindinger. Den positive polen til et molekyl blir tiltrukket av den negative polen i nabomolekylet, og danner hydrogenbindinger.
Denne typen interaksjon i væsken fordeles i alle retninger. På overflaten er kreftene rettet nedover og sideveis, for over dem er det ingen vannmolekyler. Dette gjør overflatemolekylene mer sammenhengende og skaper en elastisk film.
Overflatespenningsenheten er gitt av kvotienten mellom kraftenhet og lengdenhet, hvor den mest adopterte er dyne / centimeter (dyne / cm) og newton / meter (N / m).
Vann har høy overflatespenning, hvis verdi er 72,75 dyne / cm. Imidlertid har kvikksølv, et flytende metall, en overflatespenning som er omtrent 7 ganger større enn vann, 475 dyne / cm.
Vil du vite mer? Så sjekk ut følgende tekster:
- Vannegenskaper
- Polare og apolare molekyler
- Kjemiske bindinger
Fenomener forårsaket av overflatespenning
Overflatespenning er ansvarlig for noen fenomener vi observerer i hverdagen. De viktigste er:
Dyr som går på vannet

Insekter, edderkopper og andre dyr kan gå eller hvile på Vann fordi det på hårets ekstremiteter er hårbelagt med et fettete stoff, og derfor kan de ikke trenge inn mellom vannmolekylene som er sammenføyd på overflaten.
Dannelse av vanndråper

Vanndråpene er sfæriske på grunn av sammentrekning i molekyler overflaten forårsaket av overflatespenning. Sfæren oppstår fordi dette er den geometriske formen der det er den minste sammenhengen mellom overflateareal og volum. Derfor holder den sfæriske formen færrest antall vannmolekyler i kontakt med luften.
Øvelser på overflatespenning av vann
1. Et overflateaktivt middel er et stoff som virker på et annet for å endre:
a) Osmolaritet.
b) Overflatespenning.
c) Elektroforese.
d) Viskositet.
e) Osmotisk trykk.
Riktig alternativ: b) Overflatespenning.
a) FEIL. Osmolaritet er relatert til mengden oppløste partikler som finnes i et gitt volum løsningsmiddel.
b) KORREKT. Både vaskemidler og såper reduserer vanns overflatespenning og kalles generelt overflateaktive stoffer, fordi molekylene til disse materialene er plassert mellom vannmolekylene og reduserer spenningen overfladisk.
c) FEIL. Elektroforese er en teknikk for å skille molekyler i henhold til deres ladninger.
d) FEIL. Viskositet er en fysisk egenskap som bestemmer væskens motstand mot strømning.
e) FEIL. Osmotisk trykk er en kolligativ egenskap som tilsvarer trykket som må utøves på et system for å forhindre at osmose oppstår spontant.
Lær mer om problemene som dekkes i dette nummeret:
- Materieegenskaper
- Colligative egenskaper
- Osmotisk trykk
2. Væskes overflatespenning avhenger direkte av samhandlingsprosesser mellom molekyler, for eksempel hydrogenbinding. Hvilke av stoffene nedenfor har den høyeste overflatespenningen?
a) benzen
b) oktan
c) etylalkohol
d) karbontetraklorid
e) etansyre
Riktig alternativ: e) etansyre.
a) FEIL. Benzen er et hydrokarbon, et ikke-polært molekyl, og danner ikke hydrogenbindinger.
b) FEIL. Oktan er et hydrokarbon, og det er derfor et ikke-polært molekyl som ikke lager hydrogenbindinger.
c) FEIL. Etylalkohol er en litt polær forbindelse som kan danne hydrogenbindinger, men interaksjonen mellom molekylene er begrenset.
d) FEIL. Karbontetraklorid er en ikke-polær organisk forbindelse og danner derfor ikke hydrogenbindinger.
e) KORREKT. Den karboksylsyrefunksjonelle gruppen (-COOH) kan lage hydrogenbindinger med enten oksygen eller hydroksylhydrogen.

Lær mer om problemene som dekkes i dette nummeret:
- Polaritet av molekyler
- Organiske funksjoner
- Hydrokarboner
overflatespenningseksperiment
Se videoen nedenfor med et eksperiment som demonstrerer overflatespenningen til vann.