Den franske kjemikeren Joseph Louis Proust (1754-1826) fortsatte med å utføre nøye eksperimenter knyttet til massene av komponentene i visse reaksjoner.
For eksempel er elementene som utgjør vann hydrogen og oksygen. Proust fant at i denne vanndannende reaksjonen reagerte hydrogen alltid med oksygen i et konstant og bestemt forhold, som var henholdsvis 1: 8. Se hvordan dette skjer nedenfor:

Legg merke til det uansett hvor mye masse av elementer som brukes, vil andelen alltid være den samme.
Proust bemerket at dette ikke bare var tilfelle med vann, men med alle andre stoffer.
15,06 g kobbersulfid (CuS) dannes for eksempel ved å reagere 10,00 g metallisk kobber (Cu) med 5,06 g svovel (S). Så hvis vi dobler mengden kobber (som vil gå til 20,0 g), og hvis vi vil at alt kobber skal reagere, det vil også være nødvendig å doble mengden svovel til 10,12 g, med den totale dannelsen på 30,12 g sulfid.
Nå, hvis det tilsettes et beløp som ikke er i proporsjon, vil det overskytende beløpet bli igjen, det vil ikke reagere. Legg merke til dette nedenfor:
Ikke stopp nå... Det er mer etter annonseringen;)
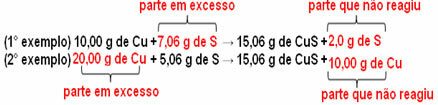
Legg merke til det reaksjonen skjer bare i henhold til den definerte andelen. Derfor konkluderte Proust i 1799 med at, når flere stoffer kombineres for å danne en forbindelse, gjøres dette alltid i et definert masseforhold.
Så han skapte en lov som heter Prousts lov, Loven om konstante proporsjoner eller Lov om definerte proporsjoner, som er angitt som følger:

Denne loven og Lavoisiers lov (Lov om massevern) heter Vektlov, fordi de snakker i masser av involverte stoffer.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Prousts lov eller lov om konstante proporsjoner"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Tilgang 27. juni 2021.

