I en isoterm transformasjon, er volum og trykkvariasjon av en viss gass, men konstant temperatur; derav opprinnelsen til det isotermiske navnet (gresk: iso = lik; termo = varme).
Forskere Boyle og Mariotte utførte isolert sett lignende eksperimenter, og resultatet oppnådd var: når trykket øker, reduseres gassvolumet.
Bare tenk for eksempel på stempelet på en sprøyte. Hvis vi legger utvendig trykk på dette stempelet, det vil si hvis vi øker trykket, vil luftvolumet som er okkupert inne i sprøyten reduseres, og omvendt.
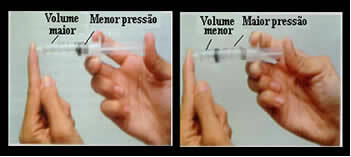
Volum og trykk er omvendt proporsjonalt: i venstre boks er trykket lite og volumet som er opptatt av luft er stort. Til høyre, når volumet påføres mer trykk på sprøytestemplet.
Dette er ikke et enkelt tilfelle, det er noe som gjentas med vanlig regelmessighet for gasser. Derfor ble dette faktum angitt i form av en lov, som kan beskrives som følger:
| Boyles lov eller Boyle-Mariottes lov: Under konstant temperatur er volumet okkupert av en fast masse av en gass omvendt proporsjonalt med trykket. |
Dette betyr at hvis vi dobler trykket til en gass, vil volumet halvere seg og så videre. Når to slike mengder er omvendt proporsjonale, er deres produkt konstant; således, matematisk, kan dette forholdet vises som følger:
Ikke stopp nå... Det er mer etter annonseringen;)
| P.V = k |
Hvor k = konstant.
Således, hvis vi i en første situasjon har trykkverdien til en viss gass som P1 og dens respektive volum som V1, så må vi:
| P1. V1 = k |
Hvis vi øker dette trykket til P2, vil volumet også bli endret til V2, og igjen må vi:
| P2 . V2 = k |
Dermed når vi konklusjonen:
| P1. V1 = P2. V2 |
Denne konstansen kan sees ved eksemplet gitt i tabellen nedenfor, av trykk og volumer av en gass med en fast masse:
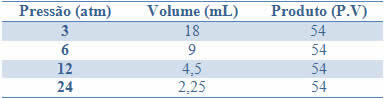
Ved å tegne disse verdiene, vil vi se dannelsen av en kurve.
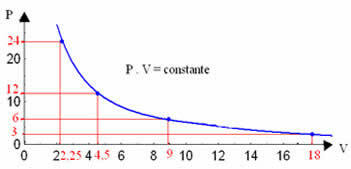
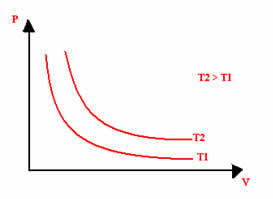
Den grafiske representasjonen av en isoterm transformasjon vil alltid være en hyperbola, uavhengig av verdiene for trykk, volum og temperatur eksperimentet ble utført ved. Denne hyperbola kalles isoterm; slik som det fremgår av grafen nedenfor, gir forskjellige temperaturer forskjellige isotermier.
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Isoterm transformasjon eller Boyles lov"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm. Tilgang 27. juni 2021.



