Når vi sier ordet "balansere", kommer en gjenstand som forblir på ubestemt tid i tankene. Dette er imidlertid bare en slags balanse, kalt “Statisk likevekt”.
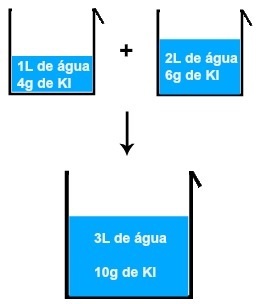
Det er også "Dynamisk likevekt". I det, som navnet sier, er det ikke et eneste øyeblikk der gjenstanden eller fenomenet i spørsmålet fortsatt er. For eksempel, for å forstå det, se illustrasjonen nedenfor og merk at mengden vann som faller i beholderen er lik mengden som strømmer ut av den, og holder vannstanden konstant. I så fall sier vi at det er en dynamisk balanse, en balanse i bevegelse.

Det er denne typen balanse som oppstår i reversible reaksjoner, det vil si i de reaksjonene som oppstår i begge retninger. Samtidig som molekylene i reaktantene blir transformert til produktene, reagerer molekylene i produktene med hverandre for å danne reaktantene. Reversibiliteten til en reaksjon er representert med piler i begge retninger:
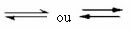
Når utviklingshastigheten for den direkte reaksjonen (av dannelsen av produktene) er lik utviklingshastigheten for omvendt reaksjon (dannelse av reaktanter), under konstant temperatur, betyr at reaksjonen har nådd sin likevekt kjemisk. Og når det gjelder reaksjoner med tilstedeværelsen av bare molekyler i reaktantene og produktene, har vi en molekylær balanse.
Ikke stopp nå... Det er mer etter annonseringen;)
Følgende er et eksempel på reaksjonen som skjer mellom hydrogengass (H2) og jodgass (I2), for dannelse av hydrogenjodid (HI) gass:
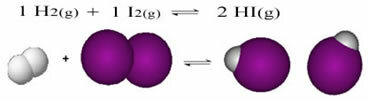
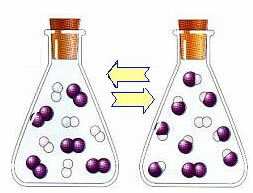
Ved begynnelsen av reaksjonen var utviklingshastigheten for den direkte reaksjonen høyere, tross alt var konsentrasjonen av reaktantene maksimal og produktene var null. Så utviklingshastigheten for omvendt reaksjon var også null.
Imidlertid reagerer hydrogen- og jodgassene over tid og genererer produktet. På denne måten begynner konsentrasjonen av reagenser å avta og deres utviklingshastighet avtar også.
Når konsentrasjonen av produkter øker og konsentrasjonen av reaktanter synker, begynner utviklingshastigheten for den omvendte reaksjonen å øke. Hvis temperaturen holdes konstant, vil det komme en tid da de to utviklingshastighetene vil forbli de samme, og viser at reaksjonen har nådd kjemisk molekylvekt.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Molecular Balance"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Tilgang 28. juni 2021.