Hver celle er en enhet der en spontan oksidasjonsreduksjonsreaksjon oppstår som genererer en elektrisk strøm, som igjen brukes til å få noe utstyr til å fungere.
Disse enhetene fikk navnet sitt fordi det første batteriet som ble opprettet ble oppfunnet av Alessandro Tilbake i år 1800 ble den dannet av sink- og kobberskiver adskilt av bomull dynket inn saltlake. Dette settet ble plassert med hverandre, hver på hverandre, balle på platene og danner en stor søyle. Hvordan var en batteri av plater, begynte å bli kalt med det navnet.

Batteriene består alltid av to elektroder og en elektrolytt. Den positive elektroden kalles a katode og det er her reaksjonen av reduksjon. Den negative elektroden er anode og det er her reaksjonen av oksidasjon. Elektrolytt kalles også saltbro og er den ioneledende løsningen.
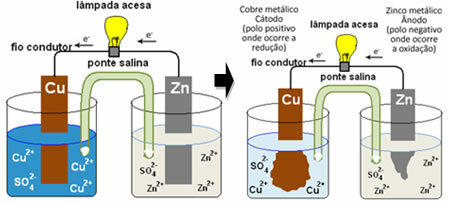
For å forstå hvordan dette genererer elektrisk strøm, se saken til et av de første batteriene, Daniels bunke, hvor det var en beholder med en løsning av kobbersulfat (CuSO4 (aq)) og, dyppet i den løsningen, var en kobberplate. I en annen separat beholder var det en løsning av sinksulfat (ZnSO
4 (aq)) og en dyppet sinkplate. De to løsningene ble forbundet med en saltbro, som var et glassrør med en kaliumsulfatoppløsning (K2KUN4 (aq)) med glassull i endene. Til slutt ble de to platene sammenkoblet av en ekstern krets, med en lampe, hvis belysning ville indikere passering av elektrisk strøm: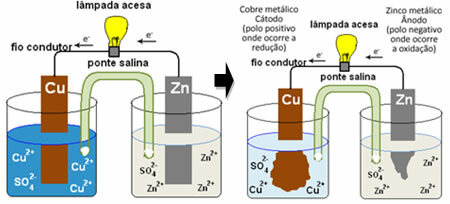
Det som skjer er at sink har en større tendens til å oksidere, det vil si å miste elektroner, slik at bladets metallsink fungerer som den negative elektroden, anoden, der oksidasjon oppstår: Zn(s) ↔ Zn2+(her) + 2 og-. Elektronene som mistes av sink, transporteres av den eksterne kretsen til kobberet, og genererer den elektriske strømmen som slår på lampen. Kobberionene i løsningen mottar elektroner (reduserer) og transformeres til metallisk kobber som avsettes på kobberplaten. Dette betyr at dette er den positive elektroden, katoden, hvor reduksjonen skjer: Ass2+(her) + 2 og- Rumpa(s).
Ikke stopp nå... Det er mer etter annonseringen;)
Dagens batterier har det samme driftsprinsippet, der ett metall donerer elektroner til et annet, gjennom en ledende løsning, og en elektrisk strøm produseres. Forskjellen er at batteriene som brukes i dag er tørre, fordi de ikke bruker en flytende løsning som elektrolytt, slik det forekommer i Daniels batteri.
I dag er det et veldig bredt utvalg av batterier som selges kommersielt. Blant dem de vanligste er syre celler (fra Leclanché) ogalkaliske batterier.
Begge har sink som negativ elektrode; på den annen side, som en positiv pol, er det en grafittstang installert i midten av bunken omgitt av mangandioksid (MnO2), pulverisert trekull (C) og en våt pasta. Forskjellen er at ammoniumklorid (NH) i syrebunken brukes i den våte pastaen.4Cl) og sinkklorid (ZnCl2) - salter av sur karakter - i tillegg til vann (H2O). I det alkaliske batteriet brukes kaliumhydroksyd (KOH), som er en base.

Leclanché-batterier er best egnet for utstyr som krever lett og kontinuerlig utladning, for eksempel fjernkontroll, veggklokke, bærbar radio og leker. Alkaliske batterier har derimot 50 til 100% mer energi enn et vanlig batteri av samme størrelse, og anbefales for utstyr som krever raskere og mer intense nedlastinger som radioer, CD / DVD-spillere, bærbare MP3-spillere, lommelykter, digitale stillkameraer etc.

Finn ut mer om hvilke elektrolytter og elektroder som brukes i disse og andre typer batterier også. hva slags utstyr de er mest anbefalt, les de relaterte artiklene mer bellow.
Av Jennifer Fogaça
Uteksamen i kjemi