Batteri det er et system der kjemisk energi transformeres spontant til elektrisk energi.
I 1836 bygde den engelske kjemikeren og meteorologen John Frederic Daniell (1790-1845) en annen bunke enn den som var kjent på den tiden: bunken til Alessandro Volta. I denne haugen han sammenkoblede to elektroder, som var systemer bestående av et metall nedsenket i en vandig løsning av et salt dannet av metallets kationer.
En av elektrodene, kobberelektroden, besto av en kobberplate dyppet i en løsning av kobbersulfat (CuSO4). Den andre elektroden var en sinkelektrode, bestående av en sinkplate nedsenket i en sinksulfat (ZnSO4) -løsning.
Disse to elektrodene var sammenkoblet av en elektrisk krets som inneholdt en lampe, for hvis den tennes, ville det indikere fremveksten av en elektrisk strøm.
Det var også en saltbro mellom dem. Denne broen besto av et U-formet glassrør som inneholdt en konsentrert vandig løsning av et høyt løselig salt, for eksempel kaliumklorid (KCl (aq)), for eksempel. Endene på røret er belagt med bomull eller agar.
Nedenfor har vi strukturen til denne cellen eller elektrokjemiske cellen, som ble kjent som Daniell-cellen. Husk at hver elektrode kalles en halvcelle.
Når kretsen er lukket, tennes lampen og etter en stund, sinkplaten er korrodert og har redusert masse, mens kobberplaten er motsatt, massen øker (som vist i figuren nedenfor). Det bemerkes også at det er en økning i konsentrasjonen i mol / L av Zn-ionene2+ og en reduksjon i Cu-ioner2+.
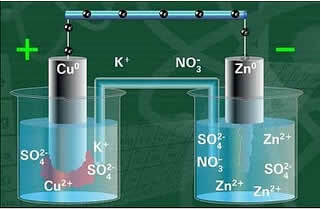
Daniels stakkskjema.
Hvorfor skjer dette?
Ikke stopp nå... Det er mer etter annonseringen;)
For å forstå, la oss se på reaksjonene som foregår ved hver elektrode separat.
I sinkelektroden oppstår følgende likevektsreaksjon:
Zn (s) ↔ Zn2+(her) + 2 og-
Dette betyr at metallisk sink (fra platen) gjennomgår oksidasjon, det vil si at det donerer to elektroner til sink-kationen (fra løsningen) og blir Zn2 +. Det motsatte forekommer også, sinkkationen som er tilstede i løsningen mottar de to elektronene som er donert av sink og blir til metallisk sink. Derfor er det en uavbrutt prosess med oksidasjon og reduksjon.
Det samme gjelder kobberelektroden, som vil ha den globale reaksjonen i dynamisk likevekt: Cu (s) ↔ Cu2+(her) + 2 og-
Daniell innså at hvis han koblet disse to elektrodene, ville den mer reaktive donere elektronene til den mindre reaktive kationen i stedet for å gjøre dette med kationene i sin egen løsning. I dette tilfellet er sink det mest reaktive og gjennomgår oksidasjon, og donerer elektroner til kobber, derav reduksjonen i massen. Elektroden som gjennomgår oksidasjon er den negative polen, kalt anoden. Kobberelektroden er den som gjennomgår reduksjon, kobberkationen mottar de to elektronene fra sink, og kalles katoden (positiv pol).
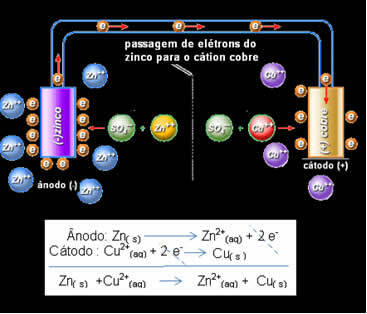
Elektronpassasje og Daniels stabile globale ligning.
Ovenfor har vi den globale ligningen for denne stabelen, som oppnås ved å legge til de to halvreaksjonene. Dens representasjon eller kjemiske notasjon er laget i henhold til følgende regel:

Så for Daniels stab har vi:
Zn / Zn2+// Ass2+ / ass
Av Jennifer Fogaça
Uteksamen i kjemi
Brasil skolelag
Fysisk-kjemisk - Kjemi - Brasilskolen
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Danills haug"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Tilgang 28. juni 2021.