Til klassifiser en sigma-lenke, det er viktig å vite hvordan man gjenkjenner det i strukturen til et molekyl. Sigma-bindingen er faktisk en kovalent binding som oppstår når to ufullstendige atomorbitaler (med bare ett elektron) interpenetrere på samme akse. Et eksempel er når en p-type (helix) bane interpenetrerer med en annen p-orbital.

p orbitaler som interpenetreres i en p-p sigma-binding
I praksis (i øvelser), anerkjennelsen og klassifiseringen av en sigma-kobling er laget av strukturformelen av et stoff, som i den strukturelle representasjonen nedenfor:

Strukturformel av hydrocyansyre
Før du klassifiserer en sigma-lenke, det er nødvendig å vite hvordan man gjenkjenner det i en strukturformel. For dette, bare husk måter som en kovalent binding er representert: samtalen enkel er representert av et enkelt bindestrek (-), par er representert av to (=) og lenken trippel er representert av tre (≡). Sigma-bindingen er til stede i en av de tre representasjonene av kovalente bindinger som følger:
Enkel: har et sigma-bånd;
Par: Av de to lenkene er bare en sigma;
Trippel: En av de tre koblingene er sigma.
Å vite hvordan du gjenkjenner en sigma-kobling, er neste trinn å lære å rangere den. For dette må vi vite hva som er den ufullstendige banen til hvert atom som er involvert i bindingen:
H - presenterer den ufullstendige s orbital, slik at den i klassifiseringen er representert med s.
Ametaler- ha en ufullstendig p-bane, så i klassifiseringen er de representert av p, med unntak av følgende elementer:
Karbon: Din ufullstendige bane avhenger av typen hybridisering at han lider. Mulighetene er: sp hybridisering3 (hvor mye koster det fire enkle samtaler), sp2 (hvor mye tjener det to enkelt- og en dobbeltbinding) eller sp (hvor mye det utfører to dobbeltbindinger eller en enkelt og en trippel). I klassifiseringen av en sigma-binding kan karbon således representeres av sp3, sp2 eller sp avhengig av samtalen du ringer.
Beryllium:lide sp-type hybridisering, således, i klassifiseringen, er representert av sp.
Bor:lide sp-type hybridisering2, således, i klassifiseringen, er den representert av sp.2.
Med all denne informasjonen er det enkleste å klassifisere sigma-koblingene i en struktur. La oss se noen eksempler:
Eksempel 1: sigmaforbindelser i vann

Strukturell formel for vann
Ikke stopp nå... Det er mer etter annonseringen;)
Strukturformelen ovenfor viser at vann har to sigma obligasjoner (to enkle), er de mellom oksygenet (representert av s) det er Hydrogen (representert av s). Dermed har vi to sigma-lenker klassifisert i:
s-s
Eksempel 2: Sigma binder seg i fosfor triklorid

Strukturformel av fosfor triklorid
Strukturformelen ovenfor viser at fosfortriklorid har tre samtalersigmas (tre enkle), de er gå inn i fosfor (representert av s) det er klor (representert av s). Dermed har vi tre sigma-lenker klassifisert i:
p-p
Eksempel 3: sigma bindinger i bortrifluorid
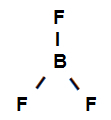
Strukturformel av bortrifluorid
Strukturformelen ovenfor viser at bortrifluorid har tre sigma lenker (tre enkle), de er gå inn i boret (representert av sp2) det er Fluor (representert av s). Dermed har vi tre sigma-lenker klassifisert i:
p-sp2
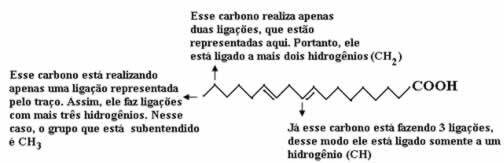
Eksempel 4: sigma obligasjoner i etanol
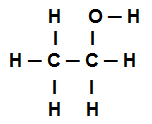
Etanol strukturformel
Strukturformelen for etanol ovenfor viser at vi har tilstedeværelse av åtte samtaler sigmas (åtte enkle lenker). Er de:
En blant Oxygen (representert av p) og hydrogenet (representert av s). Dermed blir lenken klassifisert i sigma s-p.
Ett av to karbonatomer som bare utfører sigmaforbindelser (og deretter representert av sp3). Dermed er lenken klassifisert i sp3-P3.
En blant karbonene (representert av sp3) og oksygen (representert av s). Dermed er sigma-lenken klassifisert i p-sp3.
fem mellom karbon (representert av sp3) og hydrogenet (representert av s). Dermed klassifiseres alle fem i s-sp3.
Eksempel 5: Sigma binder seg i dikloreten

Dikloreten strukturformel
Strukturformelen til dikloreten ovenfor viser at vi har nærvær av fem sigma lenker (de fire enkeltbindingene og en av dobbeltbindingene). Er de:
Ett av to karbonatomer som utfører to enkelt- og en dobbeltbinding (og deretter representert av sp2). Dermed er sigma-lenken klassifisert i sp2-P2.
Fire er mellom karbon(representert av sp2)og hydrogenet (representert ved s). Dermed er alle fire klassifisert i s-sp2.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Klassifisering av en sigmalink"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. Tilgang 28. juni 2021.