Som forklart i teksten Løsninger Metning, dannes kjemiske løsninger ved oppløsning av a løsemiddel på en løsemiddel. Hver løsemiddel har en løselighetskoeffisient spesifikk, som er den maksimale mengden oppløselig oppløselig i en gitt mengde løsningsmiddel ved en gitt temperatur.
Konstruksjon av en graf med løselighetskurve
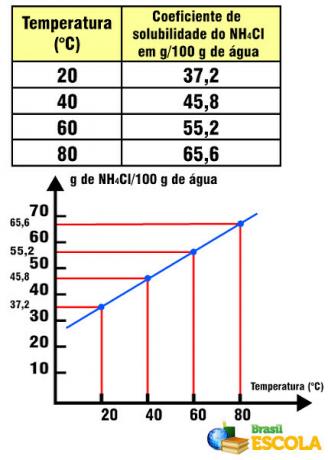
For eksempel løselighetskoeffisient av KNO3 er 31,2 g i 100 g vann ved 20 ° C. Hvis vi oppløser nøyaktig den mengden kaliumnitrat i 100 g vann ved 20 ° C, en mettet løsning. Eventuell ekstra mengde av dette saltet vil utfelle (danner et bunnlegeme i beholderen).

Løselighetskoeffisienten varierer imidlertid med temperaturen. Så hvis vi varmer opp denne mettede løsningen med KNO-bunn3, vil bunnfallet gradvis oppløses i vannet. Se nedenfor verdiene til KNO-løselighetskoeffisientene3 i 100 g vann ved forskjellige temperaturer:
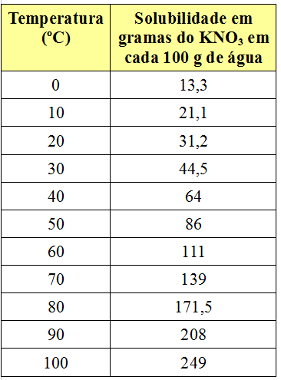
Merk at løselighet av dette saltet i vann øker med økende temperatur. I de fleste stoffer er dette også tilfelle. Hvis vi setter disse verdiene i a grafisk, vil vi ha følgende:
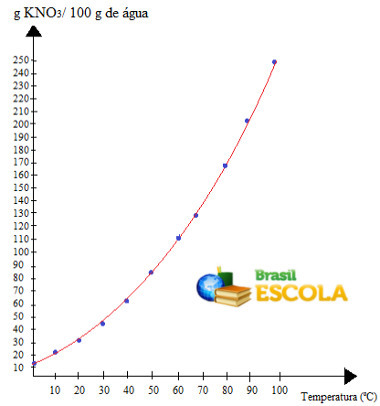
dette er samtalen løselighetskurve av KNO3. Vi sier at den stiger opp fordi den vokser med økende temperatur.
Kjennetegn på løselighetskurver for oppløste stoffer i en graf
Hvert stoff har sitt løselighetskurve for et gitt løsemiddel. Noen av disse stoffene har redusert løselighet med økende temperatur, som det er tilfellet med CaCrO4, som har løselighetskurve nedover. Dette betyr at hvis vi varmer opp en mettet løsning av saltet, vil noe av det oppløste saltet bunnfalles ut.
Som for andre stoffer forstyrrer ikke temperaturøkningen så mye i løselighet, som det skjer med en løsning av bordsalt (NaCl). Ved 20 ° C er løselighetskoeffisienten til NaCl 36 g i 100 g vann, men hvis vi øker temperaturen til 100 ° C, vil denne løseligheten bare øke til 39,8 g, en veldig liten økning.
Ikke stopp nå... Det er mer etter annonseringen;)
Det er også stoffer der løseligheten bare øker opp til et visst punkt av temperaturøkningen, for etter det avtar løseligheten. Dette skjer for eksempel med hydratiserte stoffer, som når de blir oppvarmet, når en tid de dehydrerer. Derfor, når sammensetningen endres, endres også løselighetsvariasjonen med temperaturen. Denne forekomsten kan observeres i grafen gjennom bøyninger i løselighetskurven.
Nedenfor presenterer vi en graf med løselighetskurver av forskjellige stoffer:
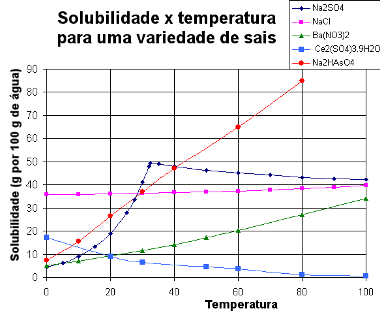
Løselighetskurver av forskjellige salter
Gjennom denne typen graf kan vi sammenligne løselighetene til forskjellige salter i samme løsningsmiddel og ved samme temperaturer.
Klassifisering av en løsning ved hjelp av en graf med en løselighetskurve
På løselighetskurver de hjelper også med å bestemme metningen av løsninger, det vil si om de er umettede, mettede, bakgrunnsmettede eller overmettede. Se et eksempel:
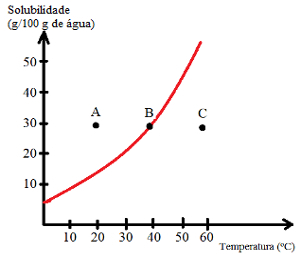
Se hvilke typer løsninger som er angitt med punktene A, B og C:
A: Mettet med bunnkropp. Ved punkt A oppløses 30 g oppløst stoff i 100 g vann ved 20 ° C. Kurven viser at på dette tidspunktet er løselighetskoeffisienten ca. 15 g / 100 g vann. Når mengden oppløst løsemiddel er større, oppnås således en mettet løsning med et bunnlegeme.
B: Mettet. Punkt B ligger nøyaktig på løselighetskurven, noe som indikerer at løsningen er mettet, da det er 30 g oppløst stoff oppløst i 100 g vann ved 40 ° C. Dette er altså nøyaktig løselighetskoeffisienten til denne løsemidlet ved denne temperaturen.
C: Umettet. Det er 30 g oppløst stoff oppløst i 100 g vann ved 60 ° C. Kurven viser at løselighetskoeffisienten på dette punktet er større enn 50 g / 100 g vann. Da mengden oppløst løst er mindre enn løselighetskoeffisienten, er det således en umettet løsning.
Dermed kan vi konkludere med at:
Poeng over kurven: mettede løsninger med bakgrunnskropp;
Poeng på kurven: mettede løsninger;
Peker under kurven: umettede løsninger.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Grafer over løselighetskurver"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm. Tilgang 28. juni 2021.
Kjemi

Dissosiasjon og ionisering, italiensk forsker Volta, elektrisk strøm, svensk fysisk kjemiker Svant August Arrhenius, teorien om Arrhenius, positive ioner, kationer, negative ioner, anioner, kaustisk brus, bordsalt, polære molekyler, dissosiasjon ionisk,