Organiske forbindelser kan representeres på en rekke måter, slik som en flat strukturformel, en forenklet eller kondensert strukturformel eller en bindestrekformel. Imidlertid er den enkleste representasjonen via molekylformelen.

La oss således se hvordan vi kan bestemme molekylformelen til organiske forbindelser, basert på de andre formlene nevnt ovenfor.
1. Gjennom den flate strukturelle formelen:denne formelen viser arrangementet eller arrangementet av atomer i molekylet. For eksempel er nedenfor den flate strukturformelen for en av hydrokarboner som er tilstede i bensin.

Merk at i denne formelen vises alle atomer og alle eksisterende bånd mellom dem. Nå, for å bestemme molekylformelen til denne forbindelsen, er det bare å telle antall atomer for hvert element og plassere en indeks nederst til høyre for det aktuelle elementet.
Et viktig aspekt som skal trekkes frem er at vi starter alltid molekylformelen til organiske forbindelser fra grunnstoffet karbon, da det er hovedbestanddelen av disse stoffene. Se eksemplet:
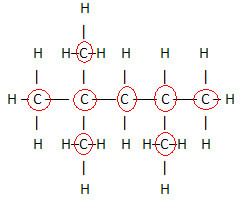
Siden det er 8 karbonatomer, begynner vi å skrive molekylformelen slik: Ç8
For å fullføre denne formelen teller vi mengden hydrogener:
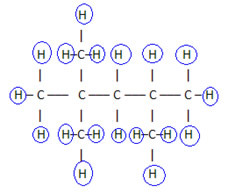
Så din molekylær formel é Ç8H18.
2. Gjennom den forenklede eller kondenserte strukturformelen: i denne formelen forkortes mengden hydrogen. Se for eksempel på den samme formelen for molekylet som finnes i bensin, nå i kondensert form:
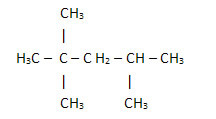
Ikke stopp nå... Det er mer etter annonseringen;)
På denne måten er det enda lettere å telle mengden hydrogener, bare legg til indeksene (3 +3+ 3 +2 +1 +3 +3 = 18).
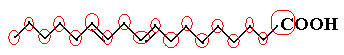
Men la oss nå se på den kondenserte strukturformelen av linolsyre, som finnes i grønnsaker som bomull, soyabønner, solsikker, etc. og som brukes i maling og lakk:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Når vi teller mengden karbon, hydrogen og oksygene, har vi følgende molekylær formel av linolsyre: Ç18H32O2.
3. Gjennom slagformelen: denne formelen forenkler videre hvordan man skal representere organiske forbindelser, da den utelater gruppene C, CH, CH2 og CH3.
Et eksempel er linolmolekylet, se hvordan det ser ut:

La oss telle mengden karbon først, og husk at i denne formelen er hver binding mellom karbon representert med bindestrek. Dermed tilsvarer spissene, så vel som de to bøyningspunktene, karbonatomer.
Så vi har: Ç18
Nå, for å telle mengden hydrogener, må vi huske at bindingene mellom karbon og hydrogen er underforstått, ettersom karbon er kjent for å danne fire bindinger; således er mengden bindinger som mangler mengden hydrogen bundet til det elementet.
Se forklaringene nedenfor:
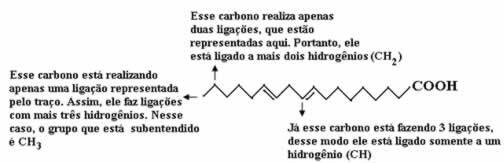
Dermed vil mengden hydrogener være: 32.

Mengden oksygen er ganske enkel å telle, da det bare er to. Siden molekylær formel é: Ç18H32O2.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Molekylære formler av organiske forbindelser"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm. Tilgang 28. juni 2021.
Karbonformel, Lewis Electronic Formula, planstruktur, elektroniske par, binding kovalent, valenslag, utvikling av atommodellen, molekylformel, strukturformel, formler tredimensjonalt.
Kjemiske formler, flat strukturformel, Couper strukturformel, trippelbinding, gass nitrogen, elektronisk formel, Lewis-formel, molekylformel, enkeltbinding, dobbeltbinding, gass karbonholdig.



