Tenk på den generiske reversible reaksjonen nedenfor, hvor små bokstaver tilsvarer de balanserte reaksjonskoeffisientene og store bokstaver er reaktantene og produktene er alle gassformede:

Med tanke på hver av reaksjonsretningene hver for seg, er utviklingshastighetene (Td) gitt av:
* Direkte reaksjon: aA + bB → cC + dD
Alledirekte = Kdirekte. [DE]De. [B]B
* Omvendt reaksjon: cC + dD → aA + bB
Alleomvendt = Komvendt. [Ç]ç. [D]d
Den kjemiske likevektskonstanten når det gjelder konsentrasjon i mengde materie (Kç) og når det gjelder delvis trykk (KP) vil bli gitt ved å dele Kdirekte av Komvendt.
Så vi har:
Kdirekte. [DE]De. [B]B = 1 → Kdirekte__ = __[Ç]ç. [D]d___
Komvendt. [Ç]ç. [D]d Komvendt [DE]De. [B]B
Å være, Kç =_Kdirekte_
Komvendt
Så vi har:
Kç =__[Ç]ç. [D]d___ eller KP =__(Praça)ç. (pD)d___ |
Hvor p er partialtrykket til hvert stoff i likevekt.
På denne måten blir hver konsentrasjon hevet til en eksponent som tilsvarer koeffisienten til det respektive stoffet i reaksjonen, og Kç har ikke enhet *.
I tillegg er et veldig viktig aspekt som skal trekkes frem, det i dette uttrykketverken faste komponenter eller rene væsker skal være representert., da bare saker som kan lide variasjon deltar i dette uttrykket. Konsentrasjonen i stoffmengde av et stoff i fast tilstand er konstant og er dermed allerede inkludert i verdien av K selv.ç. Det samme gjelder rene væsker som vann. Kort oppsummert, bare stoffer i gassform og i vandig løsning deltar i uttrykket.
Ikke stopp nå... Det er mer etter annonseringen;)
Legg merke til eksemplene nedenfor:
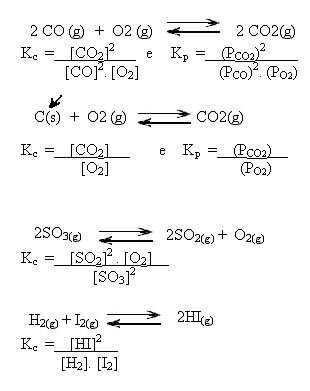
K-verdierç kan vise oss om konsentrasjonen av reaktanter og produkter er den samme eller om den ene er større enn den andre:
- hvis Kç eller KP er lik en (Kç = 1), dette betyr at konsentrasjonen av reaktanter og produkter er lik;
- hvis verdien av Kç eller KP være høy, betyr dette at produktene er i større konsentrasjon, fordi i uttrykket av Kç produktene er i telleren;
- hvis verdien av Kç eller KP er lav, betyr dette at reagensene er i høyere konsentrasjon, fordi i uttrykket av Kç reagensene er i nevneren.
* Kç og KP de er dimensjonsløse tall, det vil si rene tall, uten noen enhet relatert til noen størrelse eller forhold mellom størrelser.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Likevektskonstanter Kc og Kp"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Tilgang 28. juni 2021.